

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

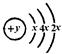
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 | A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 | 1 | |
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 | B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 | 2 | |
3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 | 3 | |
4.镁带与2mol/L的盐酸 反应 反应 | D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 | 4 | |
5铝条与2mol/L的盐酸 反应 反应 | E.生成白色絮状沉淀,继而沉淀 消失 消失 | 5 | |
6.向 溶液中滴加 溶液中滴加 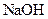 溶液至过量 溶液至过量 | F.生成淡黄色沉淀 | 6 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
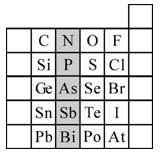
 ;F的最外层电子数是电子层数的2倍。
;F的最外层电子数是电子层数的2倍。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X可以形成钠盐,其化学式为NaX | B.X的最高价氧化物的水化物是强酸 |
| C.X的最高价氧化物的化学式为X2O7 | D.X的单质为双原子分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有第2列元素的原子最外层有2个电子 |
| B.第14列元素形成的化合物种类最多 |
| C.第3列元素种类最多 |
| D.第16、17列元素不都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com