
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
分析 (1)P的原子序数为15,原子结构中有3个电子层,最外层电子数为5;
(2)P元素的化合价由+5价降低为0,以此计算转移电子;
(3)由2S2O32-+I2═S4O62-+2I-可知,维生素C消耗的碘为aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,结合C6H8O6+I2═C6H6O6+2H++2I-计算维生素C的物质的量;
(4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同.
解答 解:(1)P的原子序数为15,原子结构中有3个电子层,最外层电子数为5,原子结构示意图为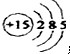 ,故答案为:
,故答案为: ;
;
(2)P元素的化合价由+5价降低为0,每生成1mol P4时,转移电子为1mol×4×(5-0)=20mol,故答案为:20;
(3)由2S2O32-+I2═S4O62-+2I-可知,维生素C消耗的碘为aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,
由C6H8O6+I2═C6H6O6+2H++2I-可知维生素C与碘的物质的量相同,则维生素C的物质的量为$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$mol,
故答案为:$\frac{a{V}_{1}-0.5b{V}_{2}}{1000}$;
(4)实验1和实验2探究该反应速率与亚硫酸钠溶液浓度的关系,实验2和实验3探究该反应速率与温度的关系;由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:探究温度、亚硫酸钠溶液浓度与该反应速率的关系;40.
点评 本题考查氧化还原反应及计算、探究影响化学反应速率的因素,为高频考点,把握反应中元素的化合价变化及反应中物质的量关系、对比实验中条件的统一,培养学生分析问题、解决问题能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)
如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
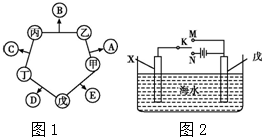 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
| A | H2SO4 | CH3COOH | NO2 | Na2O |
| B | BaSO4 | HClO | Mn2O7 | CaO |
| C | NaCl | 氨水 | SO2 | MnO2 |
| D | HI | HF | CO2 | Fe3O4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com