
【题目】将4.6 g金属钠投入到足量水中,得ag溶液;将4.8 g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为 ( )
A.a=bB.a>b
C.a<bD.无法判断
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率v(A)=0.15 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前反应速率v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有还原性 |
B | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
C | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | 稀硫酸能氧化Fe2+ |
D | 向AgNO3溶液中滴加过量氨水,得到澄清溶液 | Ag+与NH3·H2O能大量共存 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
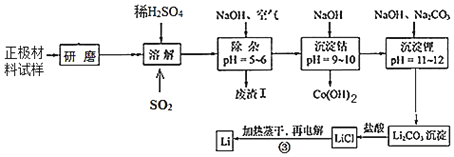
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
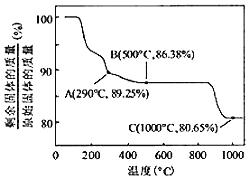
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
A. 该反应已达化学平衡状态B. 正、逆反应速率相等且等于零
C. SO2和O2全部转化为SO3D. SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②③设计成如图所示:
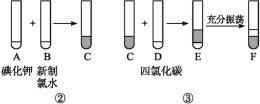
已知②中发生反应的化学方程式为Cl2+2KI![]() 2KCl+I2。
2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水的密度____的液体。F中下层液体的颜色为____色,上层液体中溶质的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于酯化反应的是( )
A.CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
B.CH2 = CH2 + Br2![]() CH2BrCH2Br
CH2BrCH2Br
C.nCH2 = CH2 ![]()
![]()
D.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com