
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计如图流程以回收铜和硫酸亚铁。请回答:
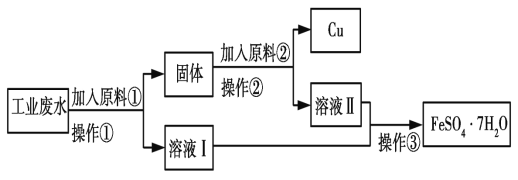
(1)反应①的离子方程式为______。
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成分是_____。(填名称)。
(4)原料②的名称为_____。
Ⅱ.回收的铜可用于制备胆矾(CuSO4·5H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
2CuSO4+2H2O。 制得硫酸铜溶液后经过蒸发、浓缩、冷却结晶、过滤可得胆矾。
(1)请分析2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
2CuSO4+2H2O反应中,氧化剂是_____,氧化产物是____(填化学式)。
(2)用双线桥标出上述反应的电子得失_____。
2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(3)若有147gH2SO4 参与反应,则转移的电子数目为_____。
【答案】Fe+Cu2+=Fe2++Cu abc 铜和铁 稀硫酸 O2 CuSO4 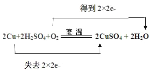 3NA
3NA
【解析】
Ⅰ.由流程图可知,向工业废水中加入过量的铁粉,铁与铜离子发生置换反应生成铜和亚铁离子,过滤,得到含有铜和铁的滤渣和硫酸亚铁溶液;向滤渣中加入适量的稀硫酸,使铁与稀硫酸反应生成硫酸亚铁和氢气,过滤,得到铜和硫酸亚铁溶液;将所得硫酸亚铁溶液混合,经过蒸发浓缩、冷却结晶、过滤、洗涤可得绿矾;
Ⅱ. 由方程式可知,反应中铜元素化合价升高,失电子被氧化,氧元素化合价降低,得电子被还原,O2是氧化剂,Cu是还原剂。
(1)反应①为铁与铜离子发生置换反应生成铜和亚铁离子,反应的离子方程式为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)操作①为固体和液体分离,该操作名称为过滤,过滤用到的玻璃仪器有:a.烧杯、b.漏斗、c.玻璃棒,故答案为:abc;
(3)由分析可知固体成分为铁和铜的混合物,故答案为:铜和铁;
(4)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜,分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质为稀硫酸,故答案为:稀硫酸;
Ⅱ.(1)由方程式可知,反应中铜元素化合价升高,失电子被氧化,氧元素化合价降低,得电子被还原,O2是氧化剂,Cu是还原剂,硫酸铜是氧化产物,故答案为:O2;CuSO4;
(2)由方程式可知,反应消耗2mol铜和1mol氧气转移4mol电子,则用双线桥表示反应的电子得失为 ,故答案为:
,故答案为: ;
;
(3)由方程式可知,反应消耗2mol硫酸转移4mol电子,147g硫酸的物质的量为![]() =1.5mol,则转移的电子数目为1.5mol×4×
=1.5mol,则转移的电子数目为1.5mol×4×![]() ×NA mol—1=3 NA,故答案为:3 NA。
×NA mol—1=3 NA,故答案为:3 NA。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA
B.1L0.1mol·L-1氨水中NH3·H2O分子数为0.1NA
C.标准状况下,1.12L氯气发生反应转移的电子数一定为0.1NA
D.46gNO2和N2O4混合气体中氧原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴及其化合物在工业上应用广泛。从某含镍废渣(含主要成分为Ni、CoO、Co2O3 及少量杂质Al2O3)提取碳酸钴、硫酸镍的工艺如下:

已知:25℃,Ksp[Co(OH)2]=4.0×10-15, lg2=0.3
(1)酸浸时需将含镍废渣粉碎,目的是_______,酸浸时通入SO2的作用是________。
(2)“除铝”时发生反应的离子方程式是______________________,25℃,若“沉钴”开始时c (Co2+) = 0.010 mo/L,则控制pH≤______时不会产生Co(OH)2沉淀。
(3)一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,可制得NiOOH沉淀,该反应的化学方程式为________。NiOOH可用于制备碱性镍氢电池,该电池工作原理: NiOOH+ MH![]() Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是___________。
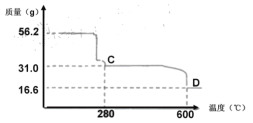
(4) NiSO4溶液可经过操作A得到NiSO4·7H2O晶体,俗称“翠矾”,操作A具体是指______________。煅烧该晶体时剩余固体质量与温度变化曲线如图,已知该曲线中D处所得产物均为氧化物,写出C到D的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mLl 8mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。

已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
(1)请写出锌与硫酸反应产生SO2的化学方程式______________。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________。
(3)长导管B的作用是______,如果没有这个设计,最终测定的临界浓度会_________。(填“偏高”、“偏低"或“无影响”)
(4)装置中干燥管C的作用是_______,请简述如何判断硫酸已达临界浓度________。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO32-进行滴定,通过滴定出的SO32-的物质的量计算临界浓度,你认为他的这一想法是否可行?________(填“可行”或“不可行”),原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁、镁和铜的混合物与一定量的浓HNO3恰好反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入2mol/L的NaOH溶液至Fe3+、Mg2+、Cu2+恰好沉淀,则消耗NaOH 溶液的体积是( )
A.400 mL B.200 mL C.150 mL D.80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具做供氧剂,主要反应的化学方程式为:_____。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反应的化学方程式:_____。
(3)野外作业中用于焊接铁轨,该反应的化学方程式为:_____。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起。试用离子方程式解释易拉罐又重新鼓起的原因______。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研发一种新型铝-石墨双离子电池,这种新型电池采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池总反应为Cx(PF6) +LiAl![]() xC + PF6-+Li+ +Al。该电池放电时的工作原理如图所示。下列说法不正确的是( )
xC + PF6-+Li+ +Al。该电池放电时的工作原理如图所示。下列说法不正确的是( )
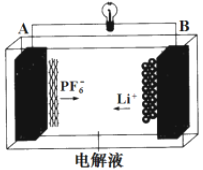
A.放电时,B极的电极反应为LiAl-e-=Li+ +Al
B.Li2SO4溶液可作该电池的电解质溶液
C.充电时A极的电极反应式为xC + PF6--e-=Cx(PF6)
D.该电池放电时,若电路中通过0.01 mol电子,B电极减重0.07 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液480mL。
(1)配制时,必须使用的玻璃仪器有___。
(2)要完成本实验该同学应称出NaOH__g。
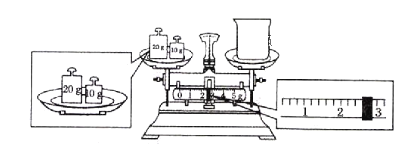
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为__g。(砝码一个20克、一个10克)
(4)使用容量瓶前必须进行的一步操作是__。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__。
①没有洗涤烧杯和玻璃棒
②定容时俯视刻度线
③未冷却到室温就将溶液转移到容量瓶并定容
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com