

 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和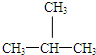
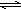 HCO3-+OH-
HCO3-+OH- 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷 .
. 分析 (1)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;分子式相同,结构不同的化合物互称为同分异构体;质子数相同中子数不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;同种物质指组成和结构都相同的物质;
(2)碳酸根离子水解显碱性;
(3)常温下,混合溶液中pH=7说明溶液呈中性,C(H+)=C(OH-);
(4)根据电荷守恒和元素守恒解题;
(5)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
解答 解:(1)①${\;}_{6}^{12}$C和${\;}_{6}^{13}$C中子数不同,是碳元素的不同原子,互为同位素,故答案为:B;
②CH3CH2CH3 和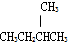 结构相似,都属于烷烃,分子组成相差2个CH2原子团,互为同系物,故答案为:C;
结构相似,都属于烷烃,分子组成相差2个CH2原子团,互为同系物,故答案为:C;
③CH3CH2CH2CH3和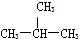 分子式相同,结构不同,为同分异构体,故答案为:E;
分子式相同,结构不同,为同分异构体,故答案为:E;
④ 和
和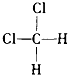 组成和结构都相同,为同一物质,故答案为:D;
组成和结构都相同,为同一物质,故答案为:D;
(2)碳酸根离子水解显碱性,涉及离子反应为CO32-+H2O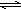 HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;
(3)常温下,混合溶液中pH=7说明溶液呈中性,则溶液中C(H+)=C(OH-),根据电荷守恒得C(H+)+C(NH4+)=C(OH-)+C(Cl-),则c(NH4+)=c(Cl-),故答案为:=;
(4)电荷守恒可知:0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据钠原子和碳原子守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故答案为:c(HCO3-)+2c(CO32-)+c(OH-);0.1mol/L;
(5)最长的碳链有7个原子, 名称为3-甲基-4-乙基-庚烷;乙烯是平面结构,取代乙烯中氢原子的碳在同一平面上,
名称为3-甲基-4-乙基-庚烷;乙烯是平面结构,取代乙烯中氢原子的碳在同一平面上, ,故答案为:3-甲基-4-乙基-庚烷;
,故答案为:3-甲基-4-乙基-庚烷; .
.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别、离子浓度大小的比较以及有机物的命名等,根据电荷守恒来分析解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3的稳定性比PH3强(填写“强”或“弱”).
;NH3的稳定性比PH3强(填写“强”或“弱”).
 NH3•H2O
NH3•H2O NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.
NH4++OH-,加入NaOH后OH-浓度增大平衡逆向移动,故有利于氨的脱除;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 被氧化的元素与被还原的元素的质量比为1:1 | |
| B. | NaBH4既是氧化剂又是还原剂 | |
| C. | NaBH4是还原剂,水是氧化剂 | |
| D. | B被氧化,H被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com