
【题目】如图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是
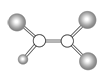
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有碳碳双键
C.该有机物可以由乙烯和氯化氢加成反应得到
D.该有机物分子中的所有原子在同一平面上
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似,如:Zn既能溶于强酸又能溶于强碱溶液。
回答下列问题:
(1)步骤I中所用的试剂可以是_________。
(2)步骤III中加入H2O2的作用是做______________。(填“还原剂”或“氧化剂”)
(3)步骤V可选用的试剂是_______(填序号)。
a.NaOH溶液 b.氨水 c.适量HCl溶液
(4)步骤VI的实验操作是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01molNH4Cl和0.002molNaOH溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
①____________
②____________
③____________。
(2)溶液中含有的微粒是__________________。
(3)在上述溶液中,电荷守恒是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
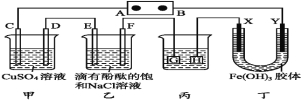
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应是 ,电镀液是 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B. Z元素的最高价氧化物水化物的酸性强于Y
C. 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D. 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生反应制取盐酸的设想,在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
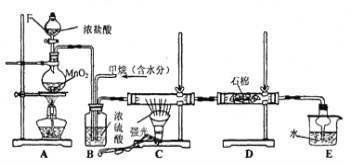
根据要求填空:
(1)装置A中反应的离子方程式为 ;
(2)B装置有三种功能:
①控制气流速度;② ;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是 ,
E装置的作用是 。
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,写出尾气中的主要成分是 。
(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)实验之余,该学习小组进一步探究甲烷与氯气反应的条件。

通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按上图安装好装置,并夹紧弹簧夹a和b。过一段时间,打开弹簧夹a、b,I、II中观察到现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如下图所示:
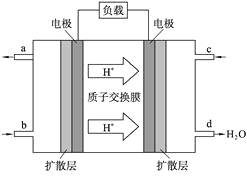
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式 。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH的电离方程式为CH3COOH![]() CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
CH3COO-+H+。在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
(1)向醋酸中加入醋酸钠固体,电离平衡 移动(填“向左”“向右”或“不”,下同);c(H+) (填“增大”“减小”或“不变”,下同),pH 。
(2)向醋酸中加入碳酸钙固体,电离平衡向 移动;c(CH3COOH) 。
(3)向醋酸中加入大量的水,c(OH-) 。导电能力 ,电离平衡常数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是________________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______ _____。
(3)元素Z与元素T相比,非金属较强的是______________(用元素符号表示);下列表述中能证明这一事实的是___________。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是_______________(填化学式),理由是_____________。T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为_______ _ ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com