


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
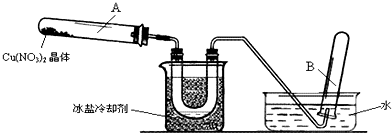
| 实 验 操 作 步 骤 | 现 象 |
| 步骤1:观察溶液. | 溶液呈暗蓝色 |
| 步骤2:取少量稀释后溶液,滴加酸性KMnO4溶液. | 紫色不消失 |
| 步骤3:取少量稀释后溶液,滴加KSCN溶液. | 变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
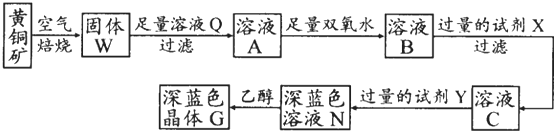
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×1016 | 2.2×1022 | 4.0×1038 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
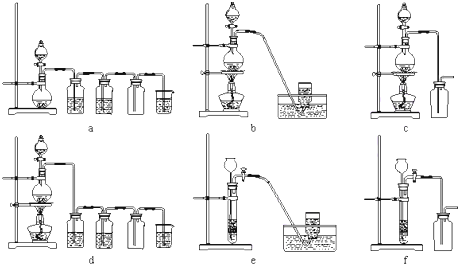
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①④ | B、只有③ |
| C、只有②③ | D、只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
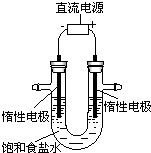 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉的分子式是C6H12O6 |
| B、淀粉可以发生银镜反应 |
| C、淀粉可以直接检验食盐中是否含有碘元素 |
| D、淀粉是天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com