


科目:高中化学 来源: 题型:阅读理解
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
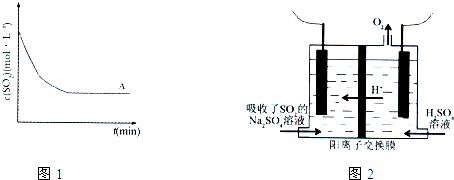
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
查看答案和解析>>
科目:高中化学 来源:浙江省余姚中学2011-2012学年高二下学期第一次质检化学试题(实验班) 题型:022
单质A与粉末化合物B组成的混合物相互转化关系如下图所示:
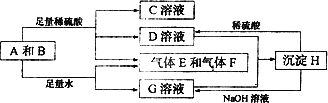
请回答下列问题:
(1)化合物B的电子式为________
(2)D与G两溶液混合后发生反应的离子方程式为________
(3)常温下,D溶液的pH________7(填“>”或“<”或”=”),其原因是________(用离子方程式表示)
(4)用碳棒,稀硫酸,气体E和气体F组成燃料电池,该电池的正极反应式为________.以该电池为电源,用惰性电极电解100 g 8%的C溶液,当电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在标准状况下的体积共为________L
查看答案和解析>>
科目:高中化学 来源:福建省福州市八中2011届高三年级上学期第一次月考试题化学试卷 题型:022
海水中蕴藏着丰富的资源,海水综合利用的流程图如下.
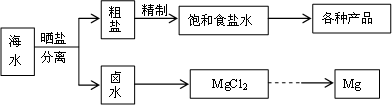
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是________.
②实验室用惰性电极电解100 mL 0.1 mol/L NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:________.
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe3+、Fe2+和Mn2+,需将Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为________,最终控制溶液的pH值为________.

②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:________.
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在.几种粒子之间有如下转化关系:
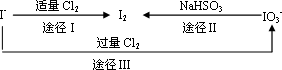
①如以途径Ⅰ制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3-与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为________.
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是
________
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]()
![]() 2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·L-1 Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·L-1 Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
(1)铅蓄电池中消耗的硫酸为 mol;
(2)停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+的物质的量浓度为 mol/L(设溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省江都中学高一第二学期期末考试化学试题 题型:单选题
NA代表阿伏加德罗常数,下列说法中不正确的是
| A.100 mL 0.5 mol/L的乙酸溶液中,乙酸分子的数目小于0.05 NA |
| B.标准状况下,22.4 L水中所含有的分予数为NA |
| C.0.8 mol乙烷中含4.8 NA个氢原子 |
| D.用惰性电极电解氯化铜溶液时,若阴极增重64g,则以石墨棒为阳极能产生NA个氯气分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com