
分析 A、B、C、D、E是核电荷数逐渐增大的前四周期元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,故D为氧元素;根据原子序数关系可知,C为N,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯,所以A为H,E原子核外未成对电子数为4,则E的核外电子排布为1s22s22p43s23p63d44s2,故E为Ti,据此解答.
解答 解:A、B、C、D、E是核电荷数逐渐增大的前四周期元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,故D为氧元素;根据原子序数关系可知,C为N,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯,所以A为H,E原子核外未成对电子数为4,则E的核外电子排布为1s22s22p43s23p63d44s2,故E为Ti,
(1)同周期元素从左到右,元素的电负性之间增强,同主族元素从上到下,元素的电负性逐渐减弱,则电负性为H<C<N<O,
故答案为:H<C<N<O;
(2)化合物N2O与CO2互为等电子体,所以分子的空间构型也相似,二氧化碳为直线型,所以N2O为分子的空间构型也为直线型,
故答案为:直线型;
(3)B、D、E三元素能形成化合物Ti(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点较低,所以Ti(CO)5晶体为分子晶体,Ti为22号元素,所以基态Ti2+离子的电子排布式为1s22s22p43s23p63d4,
故答案为:分子晶体;1s22s22p43s23p63d4;
(4)由于NH3分子之间有氢键,所以沸点比化合物CH4的高,
故答案为:高;NH3分子之间有氢键;
(5)N原子的最外层电子处于半满状态,是一种稳定结构,所以N的第一电离能大于O,
故答案为:N原子的最外层电子处于半满状态,是一种稳定结构;
(6)a.H2CO为甲醛,分子空间构型为平面三角形,而CO2为直线形,CH4为正四面体形,故a正确;
b.H2CO分子中的中心原子均采取sp2杂化,和CO2子中的中心原子均采取sp杂化,而NH3分子中采取sp3杂化,故b错误;
c.苯是非极性分子,分子中只存在一个π键,所以分子中σ键和π键的个数比为12:1,故c错误;
d.CO2是分子晶体,二氧化硅晶体是原子晶体,所以CO2的熔点、沸点都比二氧化硅晶体的低,故d正确;
故选ad.
点评 本题是对物质结构的考查,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | HBr>HCl>HF | B. | 锂>钾>钠 | ||
| C. | NaF>NaCl>NaBr | D. | 金刚石>晶体硅>碳化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液与乙酸溶液混合 HCO${\;}_{3}^{-}$+CH3COOH═CH3COO-+H2O+CO2↑ | |
| B. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | Fe2O3溶于HI溶液中 Fe2O3+6H++2I-═2Fe2++3H2O+I2 | |
| D. | 过量CO2通入NaAlO2溶液中:2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO2${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )| A. | Y电极是阳极 | |
| B. | X电极产生气体标准状况下的体积为0.56L | |
| C. | 要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 | |
| D. | 电解后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g).如图是A的反应速率v(A)随时间变化的示意图.下列说法正确的是( )| A. | 反应物A的浓度:a点小于b点 | |
| B. | 该反应的某种生成物可能对反应起催化作用 | |
| C. | 曲线上的c、d两点都表示达到平衡状态 | |
| D. | A的平均反应速率:ab段大于bc段 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:多选题
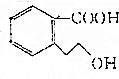 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | M的分子式为C9H10O3 | |
| B. | M 可使酸性KMnO4溶液褪色 | |
| C. | 1 mol M完全燃烧消耗10 mol O2 | |
| D. | 1 mol M能与足量Na反应生成0.5 mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com