
| A. | Fe3+ | B. | Fe2+ | C. | Cu2+ | D. | Zn2+ |
分析 某溶液中加入KSCN溶液无明显现象,说明原溶液中本来无Fe3+,再通入氯气,溶液立即变为红色,说明通入氯气后生成了Fe3+,据此分析.
解答 解:铁离子Fe3+的检验方法是在溶液中加入硫氰酸钾溶液,溶液变为血红色,证明是含有三价铁离子.
某溶液中加入KSCN溶液无明显现象,说明原溶液中本来无Fe3+,再滴加氯水,溶液立即变为血红色,说明通入氯气后生成了Fe3+,即说明原溶液含有亚铁离子,加入氯水发生反应2Fe2++Cl2=2Fe3++2Cl-,被氧化生成的铁离子和硫氰酸根离子生成血红色溶液.
故选B.
点评 本题考查了铁离子、亚铁离子的检验方法和实验现象,掌握基础是解题关键,题目较简单.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
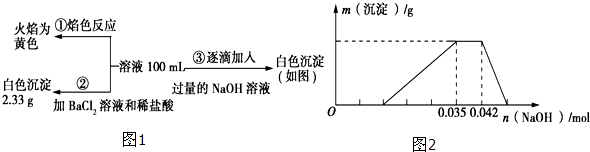
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
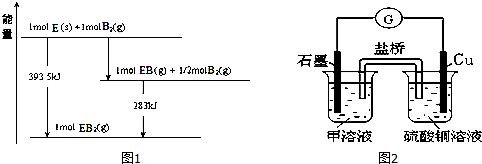
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03 mol/L | B. | 0.04 mol/L | C. | 0.05 mol/L | D. | 0.06mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2=2FeCl3+4FeI3 | |
| B. | 每1mol Co2O3在酸性溶液中被还原生成Co2+时转移2 mol e- | |
| C. | FeCl3溶液能使淀粉-KI试纸变蓝 | |
| D. | I2具有较弱的氧化性,不可以将Co2+氧化成Co2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
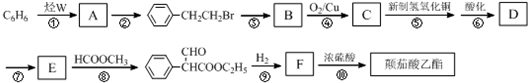
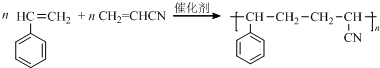 .
. .
.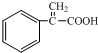 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中H2O2被氧化 | |
| B. | CNO-中N的化合价为-3价 | |
| C. | 温度越高越有利于该反应发生 | |
| D. | 每生成1.8 g H2O,转移电子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com