
NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体________________________________________________________________________g;
②将上述固体置于烧杯中,________________________________________________________________________。
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol N2与足量的H2反应,转移的电子数是0.6NA
B.常温下,0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在100 g浓度为c mol·L-1、密度为ρ g·cm-3的硫酸中加入一定量的水稀释成 mol·L-1的硫酸,则加入水的体积________ 100 mL(填“=”、“>”或“<”,下同)。
mol·L-1的硫酸,则加入水的体积________ 100 mL(填“=”、“>”或“<”,下同)。
(2)若把(1)中的H2SO4改成氨水,应加入水的体积________________________________________________________________________
100 mL。
(3)若把(1)(2)中的物质的量的浓度均改为溶质的质量分数,则加入水的体积________ 100 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
请填写下列物质的结晶方法。
(1)氯化钠:________________。
(2)硝酸钾:________________。
(3)硫酸铜晶体:______________。
(4)从FeCl3溶液中得到FeCl3·6H2O固体__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把200 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为( )
A.(10b-5a)mol·L-1 B.(2b-a)mol·L-1
C.( -
-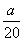 )mol·L-1 D.(5b-
)mol·L-1 D.(5b-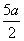 )mol·L-1
)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
 (1)该“84消毒液”的物质的量浓度约为____________ mol·L-1。
(1)该“84消毒液”的物质的量浓度约为____________ mol·L-1。
84消毒液,有效成分 NaClO
规格 1 000 mL
质量分数 25%
密度 1.19 g·cm-3
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
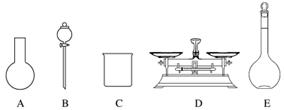
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如下图所示:
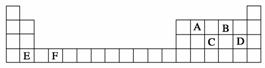
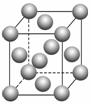
(1)写出F的基态原子核外电子排布式: 。E的晶胞结构如上图所示,该晶胞中含有金属原子的数目为________。
(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________________。
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是________,其中碳氧原子之间的共价键是________(填序号):
a.2个σ键
b.2个π键
c.1个σ键、1个π键
(4)
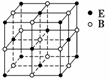
EB晶胞
EB晶胞如右图所示,EB晶体中E2+的配位数为____________,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3 401 kJ·mol-1、NaCl-786 kJ·mol-1。导致两者晶格能差异的主要原因是____________________________________________。
(5)元素A形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com