
【题目】有机花儿会务X(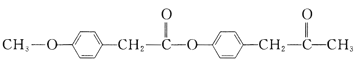 )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M(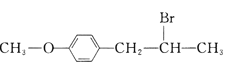 )为原料合成X的路线如下:
)为原料合成X的路线如下:
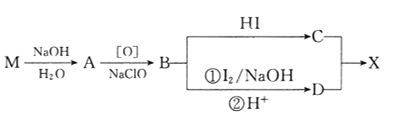

回答下列问题:
(1)B的核磁共振氢谱上有________组峰。
(2)D分子中含有的官能团有_________________________。(填名称)
(3)下列常见含钠试剂能与C反应的有______________。(填标号)
a.氯化钠 b.氢氧化钠 c.纯碱 d.碳酸氢钠
(4)由B转化为C的化学方程式为______________________________,该反应的反应类型是_______________________。
(5)E是D的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,1molE与足量钠反应可生成0.5molH2,则E可能的结构有_____种。
(6)有机物F(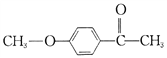 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由 ![]() 制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:![]() )_________________.
)_________________.
【答案】 5 醚键、羧基 bc ![]() 取代反应 6
取代反应 6 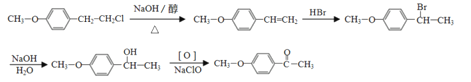
【解析】由流程图,结合信息,各物质的结构简式为:M、![]() 水解得A、A、
水解得A、A、![]() 氧化得B、B、
氧化得B、B、 与HI发生取代反应得C、C、
与HI发生取代反应得C、C、![]() 、根据信息②生成D,D、
、根据信息②生成D,D、![]() 、C和D发生取代反应得X,X、
、C和D发生取代反应得X,X、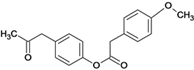 、
、
(1)B![]() 有5种不同环境的氢,核磁共振氢谱上有5组峰。(2)D
有5种不同环境的氢,核磁共振氢谱上有5组峰。(2)D![]() 分子中含有的官能团有醚键、羧基。(3)
分子中含有的官能团有醚键、羧基。(3)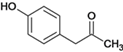 中有酚羟基,具有酸性,介于碳酸和碳酸氢根之间,下列常见含钠试剂能与C反应的有 bc。a.氯化钠呈中性,故错误;b.氢氧化钠,呈碱性,故正确;c.纯碱与酸反应生成碳酸氢钠,故正确; d.碳酸氢钠不反应,故错误;故选bc。(4)由B
中有酚羟基,具有酸性,介于碳酸和碳酸氢根之间,下列常见含钠试剂能与C反应的有 bc。a.氯化钠呈中性,故错误;b.氢氧化钠,呈碱性,故正确;c.纯碱与酸反应生成碳酸氢钠,故正确; d.碳酸氢钠不反应,故错误;故选bc。(4)由B![]() 转化为C
转化为C![]() ,由信息②,化学方程式为
,由信息②,化学方程式为![]() ,该反应的反应类型是取代反应。(5)E是D
,该反应的反应类型是取代反应。(5)E是D![]() 的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,含HCOO-官能团,1molE与足量钠反应可生成0.5molH2,可能是酚或醇,则E可能的结构有6种,结构简式如下:。
的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,含HCOO-官能团,1molE与足量钠反应可生成0.5molH2,可能是酚或醇,则E可能的结构有6种,结构简式如下:。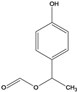 、
、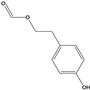 、
、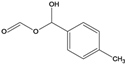 、
、![]() 、
、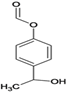 、
、![]() 。(6)由
。(6)由 ![]() 制备F,可以先利用消去反应,再利用HBr加成时,通常溴加在氢少的碳上,在苯环的α位引入官能团,合成路线
制备F,可以先利用消去反应,再利用HBr加成时,通常溴加在氢少的碳上,在苯环的α位引入官能团,合成路线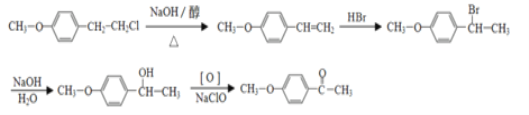


科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得某溶液中仅含有K+、Cu2+、SO42-、Cl-四种离子,其中K+、Cu2+、Cl - 三种离子的个数比为4 : 5 : 8,则K+与SO42-的物质的量比为 ( )
A.4:3
B.4:1
C.2:3
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
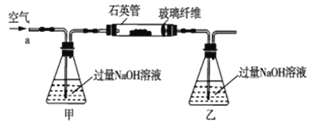
(实验一)测定硫元素的含量
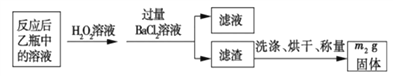
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
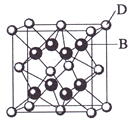
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三水乳酸亚铁晶体[(CH3CHOHCOO)2Fe3H2O,Mr=288]是一种很好的补铁剂,易溶于水,吸收效果比无机铁好。可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是______(填字母),原因是_______________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是______________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是_______________。
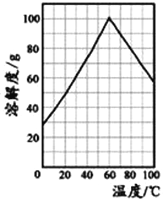
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液____________,得到FeSO4·7H2O晶体。
(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是____________________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000molL-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL。滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com