

���� ��1��̼��������跴ӦҪ�ڸ����½��У���������̼�������������Ӧ������ʵ��ʱҪ��װ���еĿ����ž���
��2������װ��ͼ��֪��Bװ�ÿ�������ȫƿ����ֹ������
��3������Ԫ���غ㣬̼��������跴Ӧ��������һ����̼Ҳ�������ɶ�����̼������Cװ������������û�ж�����̼��Dװ����������һ����̼����װ��C��D����Һ������ǣ�˵�����ж�����̼����һ����̼������������������ʵ�����ȣ�����Ԫ���غ��д����ѧ����ʽ��
��4��һ����̼�ж��������ŷŵ������У�����װ��û��β������װ�ã�
��5��ȡ18g Si02���ʵ���=$\frac{18g}{60g/mol}$=0.3mol��8.4g��̿���ʵ���=$\frac{8.4g}{12g/mol}$=0.7mol����ַ�Ӧ���ռ�����״���µ�����13.44L�����ʵ���=$\frac{13.44L}{22.4L/mol}$=0.6mol���ٶ��������ֻ��CO���������ֻ��Si��SiC��SiO2+2C=2CO+Si��Si+C=SiC�����ݻ�ѧ����ʽ���㣻
��6����֤̼�ᡢ���������ǿ����������CO2����ͨ���������Һ������Ӧ�����ɳ����ǹ��ᣬ̼������ǿ�ڹ��ᣮ
��� �⣺��1��̼��������跴ӦҪ�ڸ����½��У���������̼�������������Ӧ������ʵ��ʱҪ��װ���еĿ����ž�������ʵ��ʱҪͨ���㹻��ʱ���N2��
�ʴ�Ϊ��Ҫ�õ�����װ���еĿ����ž�����������е�������������̼��ˮ������ʵ��������ţ�
��2������װ��ͼ��֪��Bװ�ÿ�������ȫƿ����ֹ������
�ʴ�Ϊ������ȫƿ����ֹ������
��3������Ԫ���غ㣬̼��������跴Ӧ��������һ����̼Ҳ�������ɶ�����̼������Cװ������������û�ж�����̼��Dװ����������һ����̼��������C��D����ʢ�Լ��ֱ�Ϊ����ʯ��ˮ��PdCl2��Һ����װ��C��D����Һ������ǣ�˵�����ж�����̼����һ����̼������������������ʵ�����ȣ�����Ԫ���غ��֪��ѧ����ʽΪ3SiO2+4C$\frac{\underline{\;����\;}}{\;}$2CO2+2CO+3Si��
�ʴ�Ϊ������ʯ��ˮ��PdCl2��Һ��3SiO2+4C$\frac{\underline{\;����\;}}{\;}$2CO2+2CO+3Si��
��4��һ����̼�ж��������ŷŵ������У�����װ��û��β������װ�ý�CO���գ��ʴ�Ϊ��û��β������װ�ý�CO���գ�
��5��ȡ18g Si02���ʵ���=$\frac{18g}{60g/mol}$=0.3mol��8.4g��̿���ʵ���=$\frac{8.4g}{12g/mol}$=0.7mol����ַ�Ӧ���ռ�����״���µ�����13.44L�����ʵ���=$\frac{13.44L}{22.4L/mol}$=0.6mol���ٶ��������ֻ��CO���������ֻ��Si��SiC��
SiO2 +2C$\frac{\underline{\;����\;}}{\;}$2CO+Si��
0.3mol 0.6mol 0.6mol0.3mol
Si+C=SiC��
1 1 1
0.1mol 0.1mol 0.1mol
�õ�Si��SiC�����ʵ���֮��Ϊ0.2mol��0.1mol=2��1��
�ʴ�Ϊ��2��1��
��6����֤̼�ᡢ���������ǿ����������CO2������ͨ�����͵�̼��������Һ��ȥ���е��������壬Ȼ����ͨ���������Һ������ӦCO2+H2O+Na2SiO3=Na2CO3+H2SiO3����˵������H2CO3��H2SiO3��
�ʴ�Ϊ�����������Һ��ͨ�������̼���壬��Һ����ǣ�֤��̼�����Դ��ڹ��ᣮ
���� ���⿼����������ɵ�ʵ��̽�����������̷����жϣ�ʵ����ƣ�ע�������Ϣ�ķ����ж�Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1���������Һ�У�c��SO42-��c��NH4+����c��H+����c��OH-�� | |
| B�� | 0.1 mol•L-1��������Һ�У�c��OH-��=c��H+��+c��HS-��+c��H2S�� | |
| C�� | 1.0��l0-3mol/L�����pH=3.0��1.0��10-8mol/L�����pH=8.0 | |
| D�� | �����£�1mLpH=1��������l00mL pH=11��NaOH��Һ��Ϻ���Һ��pH=7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ԫ�صĻ����ﶼ�������� | B�� | ����Ԫ�صĻ����ﶼ���� | ||
| C�� | ��ˮ����ﲻ�Ǵ����� | D�� | ֻ��һ��Ԫ�ص����ʲ�һ���ǵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ʾH2��O2������Ӧ�����е������仯��H2��ȼ����Ϊ285.8 kJ/mol | |
| B�� |  ��ͼ�ó�����ȥCuSO4��Һ�е�Fe3+���ɲ�������Һ�м�������CuO��������Һ��pH��4���� | |
| C�� |  ��ʾ��ˮϡ��pH��ͬ������ʹ���ʱ��Һ��pH�仯���ߣ����Т��ʾ���ᣬ���ʾ���ᣬ����Һ�����ԣ�c��b��a | |
| D�� | 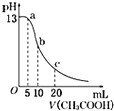 ��ʾ�����������Ϊ10 mL 0.1 mol/LNaOH��Һ����μ���0.1 mol/L CH3COOH��Һ����Һ��pH�仯���ߣ���b�㴦�У�c��CH3COOH��+c��H+��=c��OH-�� ��ʾ�����������Ϊ10 mL 0.1 mol/LNaOH��Һ����μ���0.1 mol/L CH3COOH��Һ����Һ��pH�仯���ߣ���b�㴦�У�c��CH3COOH��+c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ά����C����ǿ�Դ�Ⱦ���ĵֿ��������������нⶾ���� | |
| B�� | ά����D���ڵ��͵�ˮ����ά���� | |
| C�� | Ϊ���������߲��е�ά����C����ʧ�����߲˵�ʱ�䲻��̫�������켴�� | |
| D�� | ����ά����D����������Ƶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KCl��Һ | B�� | CH3CH2OH��Һ | C�� | CH3COOH��Һ | D�� | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com