

| ||
| △ |
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.16mol/L)2 |
| (0.04mol/L)2×0.02mol/L |


科目:高中化学 来源: 题型:
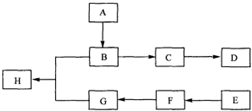
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
查看答案和解析>>
科目:高中化学 来源: 题型:
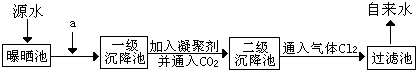
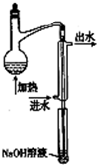
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46 | B、23 |
| C、11.5 | D、5.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
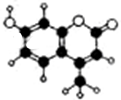 香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )
香豆素又称双呋精环,英文名称coumanin,天然存在于黑香豆,香蛇鞭菊、兰花等植物中,是一种重要的香料,还可用作抗凝血剂.香豆素-4由C、H、O三种元素组成,分子球棍模型如下图所示.下列有关叙述错误的是( )| A、分子中含有不同的含氧宫能团 |
| B、能发生水解反应,但不能使酸性KMn2O4溶液褪色 |
| C、能与H2发生加成反应 |
| D、1mol香豆素-4最多能与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,因此可用做耐火材料 |
| B、氯气具有强氧化性,因此可用于漂白棉、麻、纸张 |
| C、氨很容易液化,因此可用作制冷剂 |
| D、某些金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、SO42-、Na+、NO3-、CO32- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com