
| A、4.8 g |
| B、6 g |
| C、9.6 g |
| D、12 g |
| 6.72L |
| 22.4L/mol |
| 11.2L |
| 22.4L/mol |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、已知C (石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| B、已知C (s)+O2(g)=CO2(g);△H1,C (s)+1/2O2(g)=CO(g);△H2,则△H2>△H1 |
| C、已知CH4 (g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ/mol |
| D、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
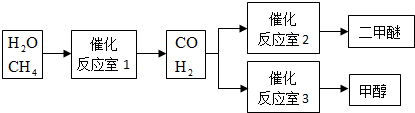
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 9.3 | --- |
| 沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、由C(s,石墨)═C(s,金刚石)△H=+1.9 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则CH3COOH和NaOH反应的生成1mo水时放出的热量为57.3 kJ |
| D、CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com