
下列有关物质结构的说法正确的是
A.电子层数多的原子的半径一定大于电子层数少的原子的半径
B.P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条
C.H2SO3酸性强于H2CO3,所以非金属性S大于C
D.不同原子形成的共价键一定是极性键
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:填空题
【化学-选修2:化学与技术】
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料采用硝酸铵氧化分解技术生产CuC1的工艺过程如下:
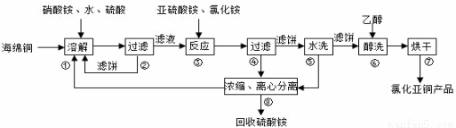
回答下列问题:
(1)步骤①中得到的氧化产物是___________,溶解温度应控制在60-70℃,原因是___________;
(2)写出步骤③中主要反应的离子方程式_________________;
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是__________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_________________;
(5)步骤②、④、⑤、⑧都要进行固液分离.工业上常用的固液分离设备有_______(填字母)
A、分馏塔 B、离心机 C、反应釜 D、框式压滤机
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:填空题
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 过程 | 化学方程式 | 焓变△H (kJ/mol) | 正反应活化能Ea (kJ/mol) |
甲烷 氧化[ | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
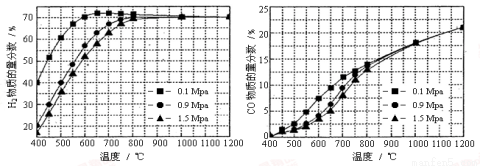
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体成分相同
B.1L 1mol/L的Na2S溶液中Na+与S2-数目总和小于3NA(NA表示阿伏加德罗常数)
C.NH4Cl溶液加水稀释后,恢复至原温度,pH和Kw均增大
D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,因此Ksp(BaSO4)﹥Ksp(BaCO3)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
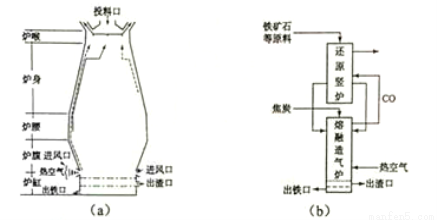
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.葡萄糖可用于合成葡萄糖酸钙口服液
B.工业制普通玻璃的原料是石英、纯碱、石灰石
C.月饼包装盒中常放入生石灰或硅胶做干燥剂,铁粉或硫酸亚铁做抗氧化剂
D.原子利用率=期望产物的原子总数与生成物原子总数之比
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:选择题
常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的氨水,所得溶液pH及导电性变化如图。下列分析不正确的是
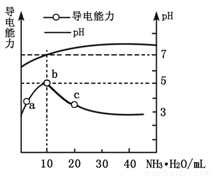
A.b点溶液pH=5,此时酸碱恰好中和
B.a~b点导电能力增强,说明HR为弱酸
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:填空题
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
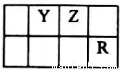
(1)Y元素位于周期表中的第__________族,
(2)化合物Q2Z2中含有的化学键类型有__________。
(3)用电子式表示化合物QR的形成过程:__________。
(4)Y2X4与AgNO3溶液反应可生成Ag、Y2和硝酸,写出该反应的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com