
下列关于物质的用途正确的是( )
A.在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多
B.人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2
C.水玻璃可用于生产粘合剂和防火剂
D.自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用
科目:高中化学 来源: 题型:选择题
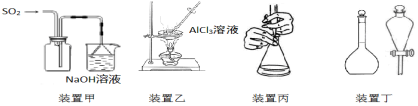
| A. | 用装置甲收集SO2 | |
| B. | 用装置乙制备AlCl3晶体 | |
| C. | 用装置丙进行中和滴定时,滴定前锥形瓶先用待装液润洗 | |
| D. | 装置丁中使用分液漏斗和容量瓶时,先要检查仪器是否漏液 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是
A.单质都是由同种元素组成的,只含一种元素的物质一定是纯净物
B.金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是( )
A. 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B. 第ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则第ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C. Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
D. NaHSO4与NaHSO3溶液显酸性,则所有酸式盐溶液均显酸性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:简答题
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
关于酸、碱、盐的下列各种说法中,正确的是
A.化合物电离时,生成的阳离子有氢离子的是酸
B.化合物电离时,生成的阴离子有氢氧根离子的是碱
C.化合物电离时,生成金属阳离子和酸根离子的是盐
D.NH4Cl通电时能电离出NH4+和Cl?,所以NH4Cl是盐
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
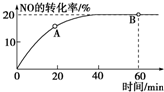 (1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.
(1)某温度下,向容积为1L的容器中充入3mol NO和1mol CO,发生2NO(g)+2CO(g)???N2(g)+2CO2(g)反应,NO的转化率随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
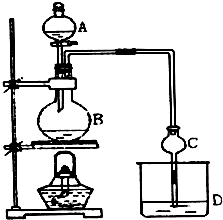 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com