
| A、c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+) |
| B、c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L |
| C、c(C2O42-)<c(HC2O4-)<c(H2C2O4) |
| D、c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) |
| 1.68g |
| 56g/mol |
| 1.68g |
| 56g/mol |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c (Na+) |
| B、c(Na+)+c(H+)=c(OH-)+c(CH3COOH)+c(CH3COO-) |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(CH3COOH)+c(CH3COO-)=0.02mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol |
| B、0.6mol |
| C、0.3mol |
| D、0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=11的溶液中:Na+、K+、HS-、ClO- |
| B、加入铝片能产生氢气的溶液中:Ba2+、K+、SO42-、HCO3- |
| C、c(H+)=c(H-)的溶液中:NH4+、Fe3+、NO3-、Cl- |
| D、c(Cu2+)=0.1mol/L的溶液中:K+、NH4+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
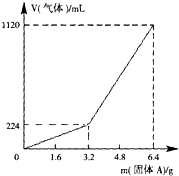 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B、加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C、无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com