
| A. | S2-的结构示意图: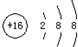 | B. | CO2的结构式:O=C=O | ||
| C. | 醋酸的分子式:CH3COOH | D. | 乙烯的结构简式:CH2=CH2 |
分析 A.硫离子质子数为16,核外电子数为18,有3个电子层,最外层电子数为8;
B.二氧化碳为直线型结构,分子中存在两个碳氧双键;
C.醋酸分子式由碳、氢、氧三种元素组成,分子式为C2H4O2;
D.乙烯的分子式为C2H4,含有1个C=C键.
解答 解:A.硫离子质子数为16,核外电子数为18,有3个电子层,最外层电子数为8,硫离子结构示意图为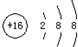 ,故A正确;
,故A正确;
B.二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,故B正确;
C.CH3COOH为醋酸的结构简式,醋酸的分子式为C2H4O2,故C错误;
D.乙烯的分子式为C2H4,含有1个C=C键,乙烯的结构简式为CH2=CH2,故D正确;
故选C.
点评 本题考查常用化学用语,题目难度不大,注意掌握结构示意图、结构式、分子式、结构简式等化学用语的书写原则,试题培养了学生规范答题的能力.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CuO 16.0g | B. | Cu(OH)2 19.6g | C. | Cu 12.8g | D. | CuCO3 24.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| B. | 原子半径:C>D>A>B | |
| C. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | C与B形成的两种化合物中化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;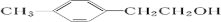 ,
, 分子中最多有13原子处在同一平面.
分子中最多有13原子处在同一平面.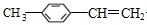 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$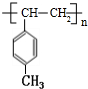 .
. +
+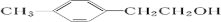 $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+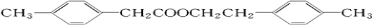 .
.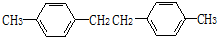 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
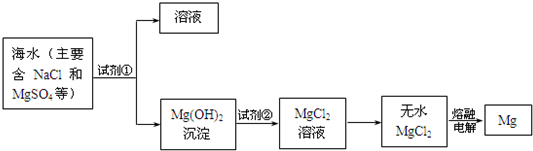
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si的原子结构示意图: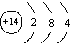 | |
| B. | 聚乙烯的结构简式 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{37}^{17}$Cl | |
| D. | HCl的电子式: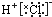 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

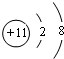 ,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com