
分析 首先计算CO2和NaOH的物质的量,结合发生的反应:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3判断反应产物即可.
解答 解:反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n (CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=1L×0.3mol/L=0.3mol,
则有:2>$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$>1,所以:所得产物为Na2CO3和NaHCO3,溶液中存在的主要阴离子有CO32-、HCO3-.
故答案为:CO32-、HCO3-.
点评 本题考查化学方程式的相关计算,题目难度不大,注意正确判断产物的成分为解答该题的关键.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
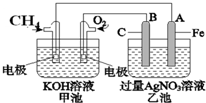 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物所具有的总键能大于反应物所具有的总键能时,反应为吸热反应 | |
| C. | 生成物的总能量大于反应物的总能量时,△H>0 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com