
| 粒子 | 键长(1.0×10-10m) | 键能(kJ•mol-1) |
| O22- | 1.49 | a |
| O2- | 1.28 | b |
| O2 | 1.21 | c=494 |
| O2+ | 1.12 | d=628 |
分析 (1)A.根据价层电子对互斥理论确定分子的空间结构,CO2为直线形结构分子;
B.原子总数相同、电子总数或价电子总数相同的互为等电子体;
C.SO2的中心原子sp2杂化,SO32-的中心原子为sp3杂化,两这空间构型不相同;
D.一个单键为一个σ键,一个双键中含一个δ键,一个π键,HCHO中含2个C-H键和1个C=O键;
(2)①根据表中数据可知:成键所用电子数越少,键能越小,O22-和O2成键所用电子数分别为2、4个;O2和O2+电子数分别为16、15;
②A.键能越大,微粒越稳定;
B.O=O键的键能为494kJ•mol-1;
C.O22-离子中无π键;
D.O2转化为O3时有σ键断裂、π键形成;
(3)利用均摊法计算共价键数目,根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有$\frac{1}{2}$个π键.
解答 解:(1)A.CO2的价层电子对个数=2+$\frac{1}{2}$(4-2×2)=2,该分子是直线形结构,故A错误;
B.SO2与O3中原子个数相等,电子总数不相同,但价电子总数相同,所以是等电子体,其空间构型相似,故B正确;
C.SO2中S原子形成2个δ键,孤电子对个数=$\frac{1}{2}$×(6-2×2)=1,价层电子对数为3,为sp2杂化,分子构型为V形,SO32-中孤对电子为$\frac{1}{2}$(6+2-3×2)=1,σ 键电子对为3,则S原子采取sp3杂化,空间构型为三角锥形,故C错误;
D.HCHO结构式为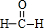 ,含2个C-H键和1个C=O键,一个单键为一个σ键,一个双键中含一个σ键,一个π键,则含3个σ键、1个π键,故D错误;
,含2个C-H键和1个C=O键,一个单键为一个σ键,一个双键中含一个σ键,一个π键,则含3个σ键、1个π键,故D错误;
故答案为:B;
(2)①O2和O2+电子数分别为16、15,键能分别为:494kj/mol、628kj/mol,说明电子数越多键能越小,其键长分别为1.21×10-10m、1.12×10-10m,键长越短,键能越大,O22-和O2成键所用电子数分别为2、4个,电子数越多键能越小,键长越短,键能越大,其键长分别为1.49×10-10m、1.28×10-10m,所以b>a,即d>c>b>a,
故答案为:d>c>b>a;键长越长,键能越小;
②A.O2、O22-键长分别为:1.21×10-10m、1.49×10-10m,键长越短,键能越大,键能越大,微粒越稳定,O2不及O22-稳定,故A错误;
B.O2中,O=O键的键能为494kJ•mol-1,故B错误;
C.O22-中,氧原子之间形成的是非极性共价单键,并且有1对共用电子,即为 ,不存在π键,故C错误;
,不存在π键,故C错误;
D.O3中含有π键,O2转化为O3时既有σ键断裂,也有π键形成,故D错误;
故答案为:A;
(3)根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30.
故答案:30.
点评 本题考查化学键类型、微粒空间构型、键能、键长等知识点,注意判断中心原子的价层电子对以及孤对电子数的判断、注意利用均摊法计算共价键数目,题目难度中等.


科目:高中化学 来源: 题型:填空题
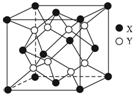 某离子晶体的晶胞结构如图所示.
某离子晶体的晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA 与等浓度等体积的 NaOH 溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA 溶液显酸性 | B. | 混合溶液中 c(OH-)、c(H+)相等 | ||
| C. | 图中 X、Y、Z 分别代表 OH-、HA-、H+ | D. | 混合溶液中:c(Na+)═c(H2A)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于13.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=3的1.0LNaHSO3溶液中,含Na+数目为0.001 NA | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA | |
| D. | 标准状况下,11.2 L的乙烯中含有的共用电子对数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OHˉ+HCO3ˉ+Ca2+=CaCO3↓+H2O | |
| C. | 钠和冷水反应:2Na+2H2O=2 Na++2OHˉ+H2↑ | |
| D. | 过量的CO2和氢氧化钙溶液的反应 OHˉ+CO32-=HCO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、P4、C10H8 | B. | PCl3、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、H2O、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅有实验①可推出肯定含有SO42-,不含Cl- | |
| B. | 该无色溶液肯定含有NH4+、K+、Al3+、SO42- | |
| C. | 该无色溶液中肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- | |
| D. | 不能确定该无色溶液是否含有K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com