
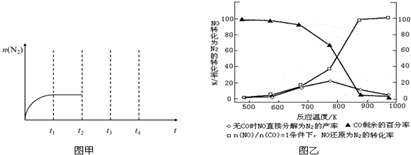
分析 (1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比;
(2)①一定温度下,向密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
若保持体积不变,再向容器中充入a mol NO,2b mol CO2,二氧化碳浓度增大量大于NO浓度增大量,浓度商大于平衡常数,平衡逆向移动;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变;
(3)若不使用CO,温度超过775K左右,NO的分解率降低,说明升高温度平衡逆向移动;
(4)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
③2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-745.5kJ•mol-1
根据盖斯定律,(①+③+②)÷2可得:C(s)+O2(g)=CO2(g).
解答 解:(1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,故2NO(g)+2CO(g)?N2(g)+2CO2(g)用平衡分压表示的平衡常数Kp=$\frac{p({N}_{2})×{p}^{2}(C{O}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$,
故答案为:$\frac{p({N}_{2})×{p}^{2}(C{O}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$;
(2)①一定温度下,向密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
若保持体积不变,再向容器中充入a mol NO,2b mol CO2,二氧化碳浓度增大量大于NO浓度增大量,浓度商大于平衡常数,平衡逆向移动,v正<v逆,故答案为:<;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变,t2-t3-t4时段N2物质的量的变化曲线为: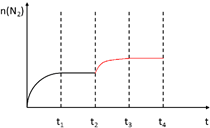 ,
,
故答案为: ;
;
(3)若不使用CO,温度超过775K左右,NO的分解率降低,说明升高温度平衡逆向移动,则正反应为放热反应,故答案为:放热反应;
(4)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
③2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-745.5kJ•mol-1
根据盖斯定律,(①+③+②)÷2可得:C(s)+O2(g)═CO2(g)△=-393KJ•mol-1,
故答案为:C(s)+O2(g)═CO2(g)△=-393KJ•mol-1.
点评 本题考查化学平衡计算与影响因素、平衡常数、盖斯定律应用等,(2)中①注意对平衡常数的理解与灵活应用,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:2c(HCO3-)+2c (CO32-)+2c(H2CO3)=c(Na+) | |
| C. | 常温下,稀释0.1mol/L的氨水,溶液中所有离子浓度均下降 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
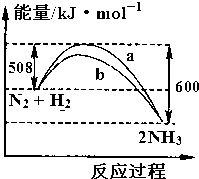
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 等物质的量的水与重水含有相同数目的中子数 | |
| C. | 氯分子的电子式: | |
| D. | 恒温恒容条件下HI分解成气态I2的反应,体系的总压强保持不变时,说明反应处于平衡态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com