

 Mg+Cl2↑ (2分);
Mg+Cl2↑ (2分); Mg+Cl2↑。
Mg+Cl2↑。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
| | 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴蒸汽、二氧化氮两种气体 | B.己烯、甲苯、四氯化碳三种液体 |
| C.溴苯、苯、乙醛三种液体 | D.氯化钠、氯化铁、氯化钾三种固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
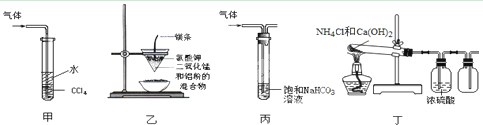
| A.装置甲:吸收尾气HCl | B.装置乙:制取金属锰 |
| C.装置丙:洗气除去CO2中的SO2 | D.装置丁:实验室制取NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.某溶液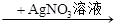 生成白色沉淀,说明原溶液中有Cl- 生成白色沉淀,说明原溶液中有Cl- |
B.某溶液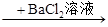 生成白色沉淀,说明原溶液中有SO42- 生成白色沉淀,说明原溶液中有SO42- |
C.某溶液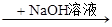 生成红褐色沉淀,说明原溶液中有Fe3+ 生成红褐色沉淀,说明原溶液中有Fe3+ |
D.某溶液 生成无色气体,说明原溶液中有CO32- 生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 待提纯的物质 | 选用的试剂 | 相应离子方程式 |
| (1) Mg (Al) | | |
| (2) FeCl3(FeCl2) | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③ | C.②④ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com