
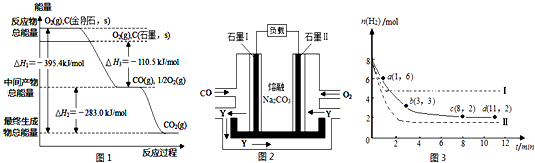
分析 (1)依据物质能量越高,越活泼分析判断,依据图象能量变化写出金刚石转化为石墨的热化学方程式,反应是放热反应;
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2.石墨Ⅰ上为CO失电子发生氧化反应;
(3)①根据v=$\frac{\frac{△n}{V}}{△t}$判断反应速率大小;
②升高温度和增大压强都能增大反应速率,缩短反应到达平衡的时间,但升高温度平衡向吸热反应方向移动,增大压强平衡向气体体积减小的方向移动;
若体积不变再充入3molCO2和4molH2,与开始6molCO2和8molH2充入2L的密闭容器中比较,相当于增加开始的一半,应采用先扩大再压缩的方法判断;
解答 解:(1)图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析金刚石转化为石墨需要放出热量=395.4KJ-393.5KJ=1.9KJ;反应的热化学方程式为C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol,故答案为:石墨;C(金刚石,s)=C(石墨,s)△H=-1.9kJ/mol;
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2,石墨Ⅰ上为CO失电子发生氧化反应,反应式为:CO-2e-+CO32-=2CO2;故答案为:CO-2e-+CO32-=2CO2;
(3)①根据图象知,A.0~1min内氢气的平均反应速率v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{8-6}{2}}{1}$mol/(L•min)=1mol/(L•min).
B.1~3min内氢气的平均反应速率v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{6-3}{2}}{2}$mol/(L•min)=0.75mol/(L.min),
C.3~8min内氢气的平均反应速率v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{3-2}{2}}{5}$mol/(L•min)=0.1mol/(L.min),
D.8~11min时该反应处于平衡状态,氢气的物质的量变化量为0,
所以反应速率最大的是A,故选A;
(2)该反应是一个反应前后气体体积减小的放热反应,改变条件I,反应到达平衡的时间缩短,则反应速率增大,达到平衡时,氢气的物质的量大于原平衡状态,说明改变条件I平衡向逆反应方向移动,所以该条件是升高温度;
改变条件II,反应到达平衡的时间缩短,则反应速率增大,达到平衡时,氢气的物质的量小于原平衡状态,说明平衡向正反应方向移动,则该条件是增大压强;
若体积不变再充入3molCO2和4molH2,与开始6molCO2和8molH2充入2L的密闭容器中比较,相当于增加开始的一半,应采用先将体积扩大到原来的1.5倍,H2O(g)的体积分数,再压缩到原来的体积,平衡向正反应方向移动,所以H2O(g)的体积分数增大,故答案为:升高温度;增大压强;增大;
点评 本题考查能量图象分析,燃料电池电极反应式的书写以及化学反应速率或平衡的图象分析,计算反应速率的大小及化学平衡状态的判断,注意把握对题目图象的分析,题目较为综合,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 14种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.
某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷 | B. | 乙烷 | C. | 甲烷 | D. | 丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com