
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:分析 (1)由图可知,c(Na+)=1.0mol/L,c(Mg2+)=0.5mol/L,结合n=cV、m=nM计算;
(2)结合电荷守恒计算c(Ca2+),结合n=cV、c=$\frac{n}{V}$计算;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,沉淀的洗涤方法:向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次.
解答 解:(1)由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.2L×1.0mol/L=0.2mol;c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.2L×0.5mol/L×95g/mol=9.5g,
故答案为:0.2;9.5;
(2)由电荷守恒可知2c(Ca2+)+c(Na+)+2c(Mg2+)=c(Cl-),解得:c(Ca2+)=$\frac{3.0-1.0-0.5×2}{2}$=0.5mol/L,混合液中CaCl2的物质的量为:0.2L×0.5mol/L=0.1mol,该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为:c=$\frac{0.1mol}{1L}$=0.1mol/L,
故答案为:0.1;0.1;
(3)加入足量硝酸酸化的硝酸银溶液,氯离子转化为AgCl沉淀,n(AgCl)=n(Cl-)=3mol/L×0.2L=0.6mol,向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次,故答案为:0.6;向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次.
点评 本题考查了物质的量、物质的量浓度的计算,题目浓度中等,明确稀释过程中溶质的物质的量不变及电荷守恒的应用方法为解答关键,注意熟练掌握物质的量浓度概念及计算方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解,过滤 | B. | 溶解,蒸发浓缩,冷却结晶,过滤 | ||
| C. | 溶解,蒸发结晶 | D. | 溶解,萃取,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量盐酸反应生成H2的体积为2.24 L | |
| B. | 32 g臭氧(O3)含的原子数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含的原子数目为1.5NA | |
| D. | 常温常压下,46g NO2和N2O4混合气体所含的原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂试剂 | 除去杂质的方法 |
| A | NaCl溶液 | BaCl2 | Na2CO3溶液 | 过滤 |
| B | NaCl溶液 | I2 | CCl4 | 多次萃取、分液 |
| C | CCl4 | 汽油 | H2O | 分液 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
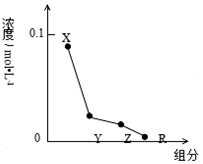
| A. | MOH的电离方程式:MOH═M++OH- | |
| B. | 该混合液中水电离出的c(H+)<l0-7mol/L | |
| C. | 该混合溶液中:c(Y)+c(X)═c(R)+c(Z) | |
| D. | 图中c(X)+c(Z)═0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L CaCl2溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com