
| A. | 34 | B. | 8.5 | C. | 17 | D. | 16 |
分析 令A的物质的量为2mol,由方程式可知,若A完全分解混合气体总物质的量为4mol,根据混合气体相对氢气密度计算混合气体的相对分子质量;若A完全不反应,根据m=nM计算混合气体总质量,由质量守恒定律可知A的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算A的相对分子质量,则A的相对分子质量介于上述两极值之间.
解答 解:令A的物质的量为2mol,
若A完全反应,由方程式2A=B+3C,可知混合气体总物质的量为1mol+3mol=4mol,混合气体对氢气的相对密度为4.25,则混合气体平均相对分子质量=2×4.25=8.5,
若A完全不反应,混合气体总质量=4mol×8.5g/mol=34g,由质量守恒定律可知A的质量为34g,则A的相对分子质量为$\frac{34}{2}$=17,
故A的相对分子质量介于8.5~17之间,
故选:D.
点评 本题考查混合物计算,注意利用极限法解答,关键是确定极限法的两个端点,为易错题目,学生容易忽略可逆反应而错选C.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 熔点:K>Na>Li | ||
| C. | 溶解度:NaHCO3>Na2CO3 | D. | 氧化性:Li+<Na+<K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙>甲>乙 | B. | 甲>乙>丙 | C. | 乙>丙>甲 | D. | 乙>甲>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
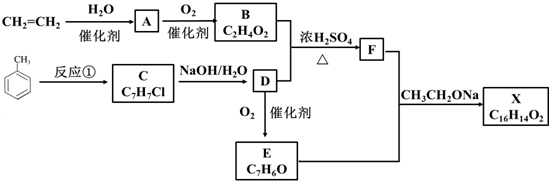
 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.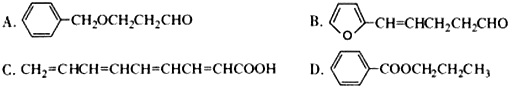
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH的电子式为Na+[:H]- | |
| B. | NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com