
��֪�����ڵ�����Ԫ��X��Y��Z��W��M��ԭ��������������X�ǿ����к�����
���Ԫ�أ��䵥�ʵĻ�ѧ���ʷdz��ȶ���Yԭ�ӵ������ֻ��2�����ӣ�Z���ʿ��Ƴɰ뵼����ϣ�WԪ���γɵĵ���Ϊ����ɫ�Ĺ��壬MԪ���γɵĵ���Ϊ����ɫ���壮��ش��������⣺
��1��XԪ�صķ����� ,�������ڱ���λ��Ϊ ��
��2��Z�������ᄃ������Ϊ ,��ѧʽ��: ��
��3��X��Y���γ����ӻ�����û�����ĵ���ʽΪ ��
��4��X������������ˮ������Y�������ﷴӦ�Ļ�ѧ����ʽΪ ��
��5��X��W�γɵ��⻯��ֱ�Ϊ���ң��Ҽס��������ĵ�������ȣ���ĽṹʽΪ ��
��6��W��M���ǽϻ��õķǽ���Ԫ�أ���ʵ����ʵ����������Ԫ�صķǽ�����ǿ�����÷���ʽ��д������˵���� ��
��1��N���ڶ����ڵ���A�壨2��ԭ�Ӿ��� ��SiO2
��3��
��4��2HNO3+MgO=Mg(NO3)2+2H2O
��5��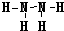
��6��Cl2+H2S=2HCl+S��
��������
���������X�ǿ����к�������Ԫ�أ�XΪ��Ԫ�أ�Z���ʿ��Ƴɰ뵼����ϣ�ZΪ��Ԫ�أ���Y��þԪ�أ�WԪ���γɵĵ���Ϊ����ɫ�Ĺ��壬MԪ���γɵĵ���Ϊ����ɫ���壬��W��MΪ���ȡ�
��1��XԪ�ط�����N���ǵ������ڵ���A��Ԫ�أ�
��2��Z����������SiO2������ԭ�Ӿ��壻
��3��X��Y�γɵ����ӻ�����ΪMg3N2����ʽΪ
��4��X������������ˮ������HNO3��Y����������MgO��������Ӧ�Ļ�ѧ����ʽΪ2HNO3+MgO=Mg(NO3)2+2H20��
��5��X��W�γɵ��⻯��ֱ�Ϊ���ң��Ҽס��������ĵ�������ȣ���ΪN2H4����ΪH2S, N2H4�ĽṹʽΪ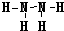 ��
��
��6��S�ķǽ����Ա�Cl����������Cl2��H2S��Ӧ�û�S��
���㣺����Ԫ���ƶϡ�Ԫ�������ڱ���λ�á��������͡�����ʽ���ǽ����ԵıȽ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��ҵ���Ʊ� BaC12 �Ĺ�������ͼ��ͼ��ʾ��

ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�顣����ã�

��1����ӦC(s) + CO2(g) 2CO(g)����H = kJ/mol
2CO(g)����H = kJ/mol
��2�����˹�������Ҫʹ�ò��������������������� ��
��3�������ܽⱺ�յĹ�������������ù��� NaOH ��Һ���գ��õ�������Һ�� Na2S ˮ������ӷ���ʽΪ ��
��4����BaCl2��Һ�м���AgNO3��KBr,�����ֳ�������ʱ��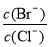 = ��[��֪��
= ��[��֪��
Ksp(AgBr) = 5.4��10��13 , Ksp(AgCl) = 2.0��10��10]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ��ƶ���
����ͼʾ��գ�

��1��������A�к��еĹ������� ��
��2��1 mol A��2 mol H2��Ӧ����1 mol E���䷴Ӧ�Ļ�ѧ����ʽ�� ��
��3����A������ͬ�����ŵ�A��ͬ���칹��Ľṹ��ʽ�� ��
��4��B���ữ����Br2��Ӧ�õ�D��D�Ľṹ��ʽ�� ��
��5��F�Ľṹ��ʽ�ǣ���E����F�ķ�Ӧ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������������Ҵ�������ˮ��Һ�й���Ļ�ѧƽ����ϵ�м��뺬�����ˮ�������㹻����ʱ����Է��֣�����ˮ�⣬��ϵ�к�������Ļ�������
A��ֻ������ B��ֻ���Ҵ�������
C��ֻ��������������� D�������������Ҵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��ֱ�����ͺ��ѻ������зֱ����������Ȼ�̼��Һ���ܷ�����Ӧ
B���л�����һ������C��HԪ�أ����ܺ���������Ԫ�ؼ�±�ص�
C��ú�к��б��ͼױ����������ȸ�������ķ��������Ƿ������
D��ʯ����Ҫ����C��H����Ԫ�أ�ʯ�ͷ���õ��ĸ���־��ǻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ��Ϫ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��25��ʱ��pH=7��NH4Cl��NH3?H2O�����Һ��c��H+��=c��OH-��=c��NH4+��=c��Cl-��
B��0.1mol/LNa2S��Һ��c��OH-��=c��H+��+c��HS-��+c��H2S��
C��25��ʱ��pH=2��CH3COOH��pH=12��NaOH�������ϣ� c��CH3COO-��+c��H+����c��Na+��+c��OH-��
D��0.1mol/LNa2CO3��Һ��2c��CO32- ��+2c��HCO- ��+2c��H2CO3��=c��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ��Ϫ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ���ǣ�
A��ͭƬ��ϡ���ᷴӦ��Cu+4H+ + NO3��=Cu2++NO��+2H2O
B��AlCl3��Һ�м��������ˮ��Al3����4OH��=AlO2����2H2O
C��FeBr2��Һ������ʵ���Cl2��Ӧ��2Fe2����2Br����2Cl2��2Fe3����4Cl����Br2
D����С�մ���Һ�м��������ʯ��ˮ��Ca2����2OH����2HCO3����CaCO3����CO32����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
���������ʰ���Ҫ���ɸߵ��͵�˳������
��1��NaF��NaCl�������ᡢSiC�������ʵ��۷е�˳�� ��
��2��C��N��O����Ԫ�صĵ�һ�����ܣ� ��
��3��H2O����Է���������H2SС�����е�ȴ�ߵ�ԭ�� ��
��4��ij��̬�Ŵط��ӵķ��ӽṹ��ͼ��ʾ���侧��ľ�����CO2����ľ���������ͬ������Ŵط��ӵķ���ʽΪ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�����а�У�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڿ��淴Ӧ4 NH3(g)+5O2(g)  4NO(g)+6 H2O(g)����������ȷ����
4NO(g)+6 H2O(g)����������ȷ����
A���ﵽ��ѧƽ��ʱ��4v��(O2)= 5v��(NO )
B������λʱ��������x mol NO��ͬʱ����x mol NH3 ����Ӧ�ﵽƽ��״̬
C���ﵽ��ѧƽ��ʱ������С���������������Ӧ���ʼ��٣��淴Ӧ��������
D���ں��������У�����������ܶȲ��ٸı䣬��Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com