
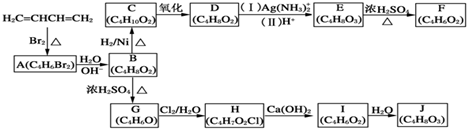
 +H2O,
+H2O,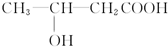 和
和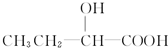 以外,还有
以外,还有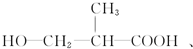 、
、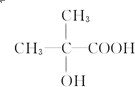 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构). ;
;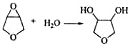 .
. 分析 D分子的不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有1个双键,D既能发生银镜反应,又能与金属钠反应放出氢气,则D中含有醛基和醇羟基,D发生银镜反应然后酸化得到的E中含有羧基和醇羟基,E反应生成F,F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1,E发生酯化反应生成F,结合F分子式知,F结构简式为 ,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
G是环状化合物,能使溴的四氯化碳溶液褪色,说明G中含有碳碳双键,结合G分子式知,B发生取代反应生成G,G结构简式为 ,
,
G→H应该是G与HClO发生加成反应,H应该为 ;I是二元环化合物,I结构简式为
;I是二元环化合物,I结构简式为 ,H→I是:2
,H→I是:2 +Ca(OH)2=2
+Ca(OH)2=2 +CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为:
+CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为: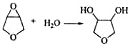 ,据此分析解答.
,据此分析解答.
解答 解:D分子的不饱和度=$\frac{4×2+2-8}{2}$=1,说明该分子中含有1个双键,D既能发生银镜反应,又能与金属钠反应放出氢气,则D中含有醛基和醇羟基,D发生银镜反应然后酸化得到的E中含有羧基和醇羟基,E反应生成F,F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1,E发生酯化反应生成F,结合F分子式知,F结构简式为 ,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
,则E为HOCH2CH2CH2COOH、D为HOCH2CH2CH2CHO、C为HOCH2CH2CH2CH2OH、B为HOCH2CH=CHCH2OH,A为BrCH2CH=CHCH2Br,生成A的反应为1,4-加成反应;
G是环状化合物,能使溴的四氯化碳溶液褪色,说明G中含有碳碳双键,结合G分子式知,B发生取代反应生成G,G结构简式为 ,
,
G→H应该是G与HClO发生加成反应,H应该为 ;I是二元环化合物,I结构简式为
;I是二元环化合物,I结构简式为 ,H→I是:2
,H→I是:2 +Ca(OH)2=2
+Ca(OH)2=2 +CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为:
+CaCl2+2 H2O;I→J是醚的开环,五元环相对于三元环稳定,因此反应为: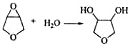 ,
,
(1)通过以上分析知,A结构简式为BrCH2CH=CHCH2Br,A生成B为取代反应或水解反应,
故答案为:BrCH2CH=CHCH2Br;取代(或水解);
(2)通过以上分析知,D结构简式为HOCH2CH2CH2CHO,
故答案为:HOCH2CH2CH2CHO;
(3)E生成F方程式为HOCH2CH2CH2COOH$→_{△}^{浓硫酸}$ +H2O;E具有相同官能团的E的同分异构体除了
+H2O;E具有相同官能团的E的同分异构体除了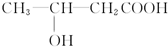 和
和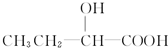 以外还有
以外还有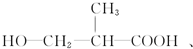 、
、 ,
,
故答案为:HOCH2CH2CH2COOH$→_{△}^{浓硫酸}$ +H2O;
+H2O;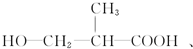 ;
; ;
;
(4)G结构简式为 ,故答案为:
,故答案为: ;
;
(5)I→J是醚的开环,五元环相对于三元环稳定,反应方程式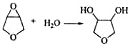 ,故答案为:
,故答案为: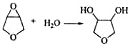 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及信息的综合运用能力,正确推断F结构简式是解本题关键,然后采用正逆结合的方法进行推断,注意I结构简式的确定,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题

| A. | 图1中正极电极反应式为:O2+4e-+4H+=2H2O | |
| B. | 图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| C. | 图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始滴入NaOH溶液时立即产生白色沉淀 | |
| B. | 原固体混合物中镁的质量是1.2g | |
| C. | V=100mL | |
| D. | 若将5.1g该合金溶于足量的氢氧化钠溶液,在常温常压下放出3.36L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有漂白性 | |
| B. | 元素周期表中第IA族全部是金属元素 | |
| C. | 盛有浓硫酸的烧杯敞口放置一段时间后,质量增加 | |
| D. | 硫在纯氧中的燃烧产物是三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com