
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:
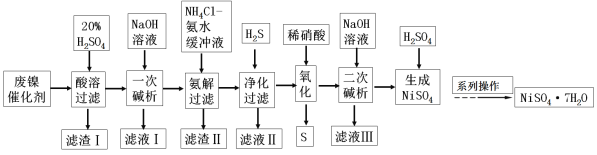
已知:① NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,该操作的目的为_____。
(2)“滤渣I”主要成分在工业上的用途为___(只写1种即可),NH4Cl的电子式为_____。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为____。
(4)“氨解”的目的为________, “净化”时加入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为:________。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于____。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)工业上利用电解法处理含氯化镍的酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是________。
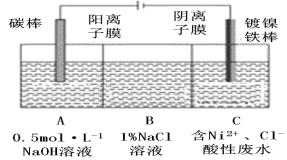
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】加快反应速率,提高镍元素的浸出率 制玻璃或制光导纤维 ![]() Cr3++4OH-=CrO2-+2H2O 实现镍元素和铁元素的分离 [Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑ 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol·L-1 B
Cr3++4OH-=CrO2-+2H2O 实现镍元素和铁元素的分离 [Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑ 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol·L-1 B
【解析】
废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)
经酸溶得到硫酸镍、硫酸铁、硫酸铬溶液,二氧化硅不溶于酸为滤渣Ⅰ的主要成分;向滤液中加入氢氧化钠溶液得到氢氧化镍沉淀、氢氧化铁沉淀、偏铬酸钠溶液,偏铬酸钠溶液为滤液Ⅰ的主要成分;向沉淀中加入NH4Cl—氨水的混合液,氢氧化铁沉淀不溶于此溶液,为滤渣Ⅱ的主要成分,氢氧化镍沉淀溶于此溶液得到[Ni(NH3)6]2+溶液;向溶液中通入H2S,生成NiS沉淀;向沉淀中滴入稀硝酸得到硝酸镍;向硝酸镍中加入氢氧化钠溶液得到氢氧化镍沉淀;向沉淀中加入硫酸得到硫酸镍;在经过系列操作得到NiSO4·7H2O。据此解答。
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,是为了增大接触面积,加快反应速率,提高镍元素的浸出率。本小题答案为:加快反应速率,提高镍元素的浸出率。
(2)二氧化硅不溶于稀硫酸,则“滤渣I”主要成分是二氧化硅, 二氧化硅主要应用于制玻璃或制光导纤维;NH4Cl中即含离子键又含共价键,是离子化合物,电子式为![]() 。本小题答案为:制玻璃或制光导纤维;
。本小题答案为:制玻璃或制光导纤维;![]() 。
。
(3)根据信息可知,Cr(OH)3是两性氢氧化物,性质类似于氢氧化铝,铬离子与少量氢氧化钠反应生成氢氧化铬,若氢氧化钠过量,则过量的氢氧化钠与氢氧化铬继续反应生成偏铬酸钠,故“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为Cr3++4OH-=CrO2-+2H2O。本小题答案为:Cr3++4OH-=CrO2-+2H2O。
(4)废镍催化剂中的铁元素在“一次碱析”时转化为氢氧化铁,由于Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+,则 “氨解”的目的是实现镍元素和铁元素的分离;“净化”时加入H2S,H2S与[Ni(NH3)6]2+发生反应生成NiS沉淀,离子方程式为[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑。本小题答案为:实现镍元素和铁元素的分离;[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑。
(5)“氧化”时发生的反应是稀硝酸和NiS的反应,根据流程图反应生成S,则稀硝酸中的氮元素由+5价降低到+2价生成NO,NiS中的硫元素由-2价升高到0价生成S单质,根据得失电子守恒、电荷守恒和原子守恒,反应的离子方程式为3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O。本小题答案为:3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O。
(6)氢氧化镍中存在溶解平衡,![]() 。根据信息离子浓度≤10-5mol·L-1时,离子沉淀完全,则
。根据信息离子浓度≤10-5mol·L-1时,离子沉淀完全,则![]() ,c(OH-)=1.4×10-5mol·L-1, 则若使溶液中的Ni2+沉淀完全,需维持c(OH-)不低于1.4×10-5mol·L-1。本小题答案为:1.4×10-5mol·L-1。
,c(OH-)=1.4×10-5mol·L-1, 则若使溶液中的Ni2+沉淀完全,需维持c(OH-)不低于1.4×10-5mol·L-1。本小题答案为:1.4×10-5mol·L-1。
(7)A. 由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH4e=2H2O+O2↑,故A正确;
B. 镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e=Ni,电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;
C. 因Ni2+在弱酸性溶液中易发生水解;氧化性Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;
D. 若将图中阳离子膜去掉,由于放电顺序Cl>OH,则Cl移向阳极放电:2Cl 2e=Cl2↑,电解反应总方程式会发生改变,故D正确。答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是:
A. C2H4 B. C2H4O2
C. C2H6O D. C4H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图所示装置进行NaHCO3的受热分解实验。请回答:

(1)加热一段时间后,烧杯中观察到的实验现象是_________。
(2)实验结束时的正确操作是_____(填序号)否则会引起_______。
① 先将导管从液体中移出,再熄灭酒精灯
② 先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是
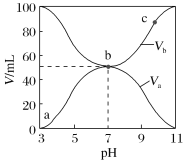
A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. b点,c(NH4+)+c(HX)=0.05 mol·L-1
C. a→c点过程中,  值不变
值不变
D. a、b、c三点,c点时水电离出的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】始组鸟(pterodactyl adiene)形状如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是

A. 始祖鸟烯与乙烯互为同系物
B. 若R1=R2=甲基,则其化学式C12H16
C. 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种
D. 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某另类元素周期表的一部分,下列说法正确的是( )

A. 简单阴离子的半径大小:X>Y>Z
B. 单质的氧化性:X>Y>Z
C. Y的氢化物只有一种
D. X的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它们可以组成化合物A2C、B2C2、DC2、D2A4等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。请回答:
(1)写出元素符号:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为__________;按原子轨道重叠方式,其非极性键的类型是________。化合物DC2的结构式__________。
(3)A2C分子的电子式____________,按原子轨道重叠方式,其共价键的类型是____________。D2A4是平面形分子,其分子中含有______个σ键,______个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式:___________________________________________;
B2C2与DC2反应的化学方程式:___________________________________________;
B与A2C反应的离子方程式:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com