
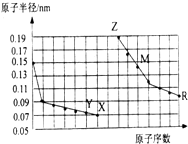
| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,稀有气体原子半径大于同周期VIIA元素原子半径,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,Y为O元素,X为F元素,Z为Na元素,M为Al元素,R为Cl元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,稀有气体原子半径大于同周期VIIA元素原子半径,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,Y为O元素,X为F元素,Z为Na元素,M为Al元素,R为Cl元素.
A.O2-、F-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->F->Na+,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定,故稳定性HF>H2O,故B错误;
C.铝离子半径小于钠离子比较,且铝离子所带电荷大,故Al晶体中金属键更强,则单质熔点Al>Na,故C正确;
D.Na单质与水反应生成氢氧化钠与氢气,不能从M的盐溶液中置换出单质M,故D错误,
故选:C.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
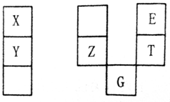 X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠长期暴露在空气中的产物是NaHCO3 | |
| B. | 金属钠燃烧时火焰为黄色 | |
| C. | 钠与钠离子都具有强还原性 | |
| D. | 在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X元素最高价氧化物对应的水化物为弱酸 | |
| B. | Y元素最外层电子数是最内层电子数的2倍 | |
| C. | 原子半径:Y>X>Z | |
| D. | X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com