
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 | ||
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
分析 A.氨气分子之间存在氢键,沸点高于PH3;
B.原子晶体沸点高于分子晶体,金刚石、晶体硅属于原子晶体,原子半径越小,键能越大,熔沸点越高,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体;
C.晶格能越大,离子晶体熔沸点越高,离子电荷越大、半径越小,晶格能越大;
D.金属键越强,金属晶体的熔沸点越高,离子电荷越大、半径越小,金属键越强.
解答 解:A.氨气分子之间存在氢键,沸点高于PH3,故A错误
B.金刚石、晶体硅属于原子晶体,原子半径C<Si,故键能C-C键>C-Si键,故沸点Si<SiC,水与二氧化碳均形成分子晶体,常温下水为液态,而二氧化碳为气体,水的沸点较高,原子晶体的沸点高于分子晶体,故B错误;
C.均为离子晶体,离子所带电荷相同,离子半径I->Br->Cl->F-,故NaI、NaBr、NaCl、NaF的晶格能依次增大,离子晶体沸点升高,故C正确;
D.离子所带电荷相同,离子半径径Li+<Na+<K+<Rb+,金属键减弱,金属晶体的沸点降低,故D错误,
故选:C.
点评 本题考查晶体熔沸点高低比较,难度不大,注意理解掌握熔沸点高低比较规律,有利于基础知识的巩固.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
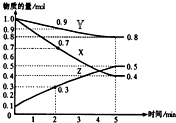 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L | B. | 1.12L | C. | 1.68L | D. | 2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
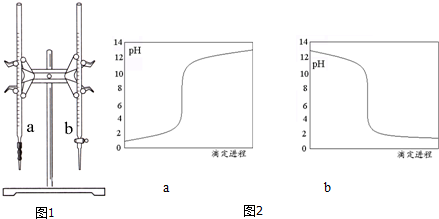
| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com