
【题目】某同学为改进金属钠与氯气反应的实验,设计了如下装置。
![]()
可供选择的试剂有:金属钠、MnO2、KClO3固体、盐酸、NaOH溶液、澄清石灰水。
(1)玻璃仪器C的名称是____。
(2)针筒A中放的是盐酸,则B中放的是____。
(3)针筒D的作用是____。
科目:高中化学 来源: 题型:
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.2mol·L-1Na2CO3溶液230mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是__________,在使用该仪器前必须进行的操作是_______。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有多个操作,请简述定容的过程:________。
(4)配制过程中,下列操作会引起所配溶液的浓度偏大的有____(填序号)。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以白云石(主要含CaCO3)为原料,按以下工艺流程制备某种新型的超导材料12CaO·7Al2O3。
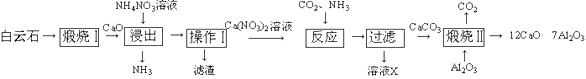
(1)若在实验室中进行“煅烧Ⅰ”的操作,可将样品放在_____________(填仪器名称)中加热;操作Ⅰ的名称是_____________。
(2)“浸出”过程中,CaO先与水反应生成Ca(OH)2,写出Ca(OH)2与NH4NO3溶液反应的化学方程式:_____________;检验“浸出”过程中有NH3生成的方法是___________。
(3)溶液X在流程中能循环利用,其中所含主要溶质的化学式为______。
(4)“煅烧Ⅱ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.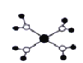 四水合铜离子([Cu(H2O)4]2+)的模型如图所示,铜离子与水分子的氧原子形成4个配位键
四水合铜离子([Cu(H2O)4]2+)的模型如图所示,铜离子与水分子的氧原子形成4个配位键
B.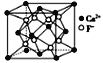 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,电子云密度大的区域电子数目多
H原子的电子云图如图所示,电子云密度大的区域电子数目多
D.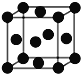 金属Cu的晶胞结构如图所示,晶胞中Cu原子的配位数为12
金属Cu的晶胞结构如图所示,晶胞中Cu原子的配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.02×1023
③2molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有NA个氯原子
A.①③④⑥⑧B.①④⑤C.①②⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空.
(1)等质量的SO2和SO3所含氧原子个数之比__________
(2)4.8gCH4中所含氢原子个数与____________g水所含氢原子数相等
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为_____________,R的相对原子质量是_________
(4)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为________,一氧化碳和二氧化碳的物质的量之比为___________,若将此混合气体通入足量的澄清石灰水中,生成的沉淀的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的 ( )
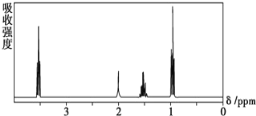
A.CH3CH2CH2CH3B.(CH3)3CCH3
C.CH3CH2CH2OHD.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
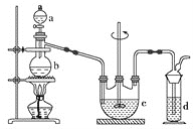
回答下列问题:
(1)a中试剂为__________,b中试剂为__________,c中试剂为____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可以采取的措施有________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com