
【题目】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
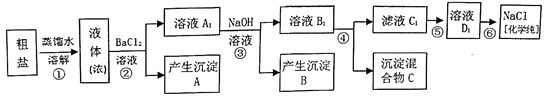
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________,②___________________________。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________。
【答案】碳酸钠 过滤 CO32-+2H+=H2O+CO2↑;H++OH-=H2O 取A1中溶液少许,滴加氯化钡溶液,若无浑浊产生,则硫酸根离子已完全除尽 ②与③或③与④
【解析】
(1)根据操作第④、⑤步所加试剂名称及第⑥步操作的原理分析,碳酸钠会除去反应剩余的氯化钡,离子都形成沉淀,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠;
(2)溶液中含有过量的氢氧化钠、碳酸钠以及要保留的氯化钠溶液,可以再加入盐酸将碳酸钠和氢氧化钠除掉;
(3)根据SO42-+Ba2+=BaSO4↓,产生白色沉淀进行解答;
(4)先除镁离子,还是先除硫酸根离子都行,但是加入的碳酸钠要放在加入的氯化钡之后;
(1)操作第④步是除Ca2+,加Na2CO3溶液转化为沉淀,Ca2++CO32-=CaCO3↓,同时碳酸钠还除去反应剩余的氯化钡溶液引入的杂质Ba2+,Ba2++CO32-=BaCO3↓;
操作②是分离难溶性固体与溶液混合物的方法,名称是过滤;
(2)滤液C1中含有过量的氢氧化钠、碳酸钠及要保留的氯化钠溶液,可向该溶液中加入足量的盐酸,盐酸与杂质碳酸钠和氢氧化钠反应变为气体或水除掉,反应的离子方程式是:H++OH-=H2O ;CO32-+2H+=H2O+CO2↑ ;
(3)向混合溶液中加入BaCl2溶液,发生反应:SO42-+Ba2+=BaSO4↓,产生白色硫酸钡沉淀,若硫酸根离子已完全除尽,那么取A1中溶液少许,滴加氯化钡溶液,就不会出现浑浊现象;若出现浑浊现象,证明溶液中还存在硫酸根离子;
(4)首先要把粗盐溶于水形成溶液,然后Mg2+用OH-沉淀除去,加入过量的氢氧化钠可以将镁离子沉淀,SO42-用Ba2+沉淀,加入过量的氯化钡可以将Ba2+沉淀,至于先除Mg2+,还是先除SO42-都没有关系,Ca2+用CO32-沉淀,除Ca2+加入碳酸钠转化为沉淀,Ca2++CO32-=CaCO3↓,但是加入的碳酸钠一定要放在加入的氯化钡之后,这样碳酸钠溶液既可以除去原溶液中的CaCl2,也可以除去因除Na2SO4杂质加入的过量的BaCl2溶液,Ba2++CO32-=BaCO3↓,离子都形成沉淀,一起进行过滤,所以②与③或③与④步骤调换顺序,不影响实验结果;


科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50mL1mol/L的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A. 75mL3mol/L的NH4Cl B. 150mL1mol/L的NaCl
C. 50mL1.5mol/L的CaCl2 D. 50mL3mol/L的NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向1mol/LCH3COOH溶液中逐滴加入1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是
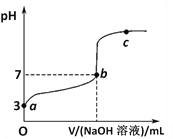
A. a与c之间的溶液中b点水的电离程度最大
B. 溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-)的点一定在a与b之间且靠近b
C. b点时,NaOH溶液与醋酸不是恰好反应,V(NaOH溶液)<V(CH3COOH溶液)
D. a、b、c点表示的溶液中c(CH3COO-)/[ c(CH3COOH)·c(OH-)]均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学做中和滴定和中和热的测定两个实验。
Ⅰ.下图是该小组同学用0.5000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和第1次滴定前、后盛放盐酸的滴定管中液面的位置。请回答下列问题。

(1)仪器A的名称是_______________。
(2)第1次滴定消耗标准液_________mL 。
(3)已知每次滴定操作所取待测NaOH溶液的体积均为20.00mL。第2、3、4次滴定数据如下表所示。通过计算得待测NaOH溶液的平均浓度是___________mol/L。(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
2 | 20.00 | 1.20 | 21.20 |
3 | 20.00 | 2.24 | 22.26 |
4 | 20.00 | 1.50 | 21.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.向锥形瓶里注入20.00 mL待测NaOH溶液,并滴入2-3滴酚酞;
B.用标准溶液润洗酸式滴定管2-3次;
C.固定好装标准溶液的酸式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2-3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准HCl溶液滴定至终点并记下滴定管液面刻度。
合理的操作顺序是(用序号字母填写)______________________________。
(5)如何判断到达滴定终点?_________________________________________。
(6)如果上述B步骤省略,对测定结果的影响是_________;标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是______(填“无影响”、“偏高”、“偏低”)。
Ⅱ.现用上述盐酸和已测出浓度的NaOH溶液,设计如下装置测定中和热。
将50mL盐酸与50mL NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(7)从图示看此装置存在错误,请指出_________________。
(8)当室内温度低于10℃时,对实验数据影响很大,实验测得的中和热数值偏小。其原因是___________________。
(9)如果实验测得起始温度为t1℃,反应后的最高温度为t2℃,则中和热的表达式为ΔH =___________。(中和后溶液的比热容c=4.18J/(g.℃))
(10)本次实验室内温度正常,操作无误,但是数据偏低,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
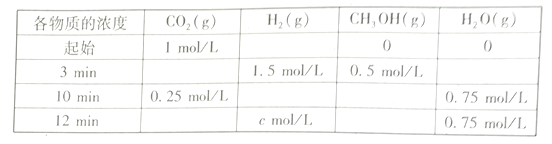
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
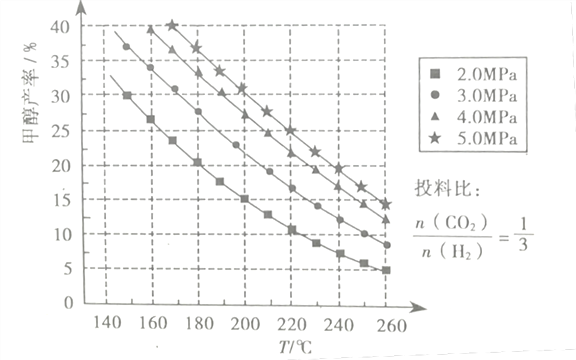
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。
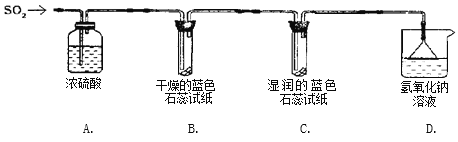
(1)A装置的作用是______________。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成_____色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,写出反应的化学方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终成_______。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_____。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(1)酸雨造成的危害是:______________________________。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中正确的是
A. 构成锌铜原电池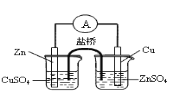
B. 实验室制氨气并收集干燥氨气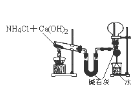
C. 验证溴乙烷发生消去反应生成烯烃
D. 由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: ![]() ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是

A. 相同条件下,正反应速率: v(A) >v(B)
B. 若在恒容条件下加入稀释剂(N2),能增大乙苯的转化率
C. 若A点乙苯的转化率为60%,则混合气体中苯乙烯的37.5 %
D. 用平衡分压来代替平衡浓度计算,其中分压=总压×物质的量分数,则600℃时,B点的平衡常数Kp=0.019MPa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com