
| A、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、c(OH-)=10-13mol?L-1的溶液中:SO32-、CO32-、Na+、K+ |
| C、在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- |
| D、加入Mg能放出H2的溶液中:K+、NH4+、Cl-、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
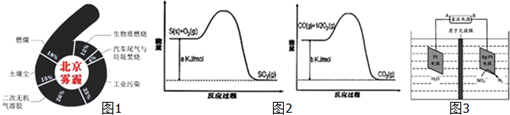
| 催化剂 |
| 180℃ |
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
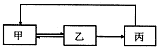 下表中各组物质之间不能通过一步反应实现如图转化的是( )
下表中各组物质之间不能通过一步反应实现如图转化的是( )| 甲 | 乙 | 丙 | |
| A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
| B | SiO2 | H2SiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al(OH)3 | Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热碱液清洗铝材表面的油污时,会有气泡冒出 |
| B、电解精炼铜,电解结束后电解液浓度不变 |
| C、Fe2+、H+、NO3-三者不共存的原因为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| D、硬铝是以铝为主要合金元素的合金材料,其熔点低于纯铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com