
| A. | H2SO4→HCl→NaOH→CO2 | B. | Na2SO4→NaCl→NH3•H2O | ||
| C. | NaCl→Na2SO4→NaOH | D. | Na2SO4→NaCl→NaOH |
分析 沉淀银离子需要用氯离子,沉淀钡离子需要用硫酸根离子,沉淀镁离子需要加入氢氧化钠,由于银离子与硫酸根离子、氢氧根离子反应,故应该先加入氯化钠沉淀出银离子,然后用硫酸钠沉淀出钡离子,最后用氢氧化钠沉淀出镁离子,据此进行解答.
解答 解:A.由于硫酸能够与Ag+、Ba2+反应,无法逐一形成沉淀,故A错误;
B.由于Na2SO4能够与Ag+、Ba2+反应,无法逐一形成沉淀,故B错误;
C.先加入NaCl得到AgCl沉淀,再加入过量Na2SO4得到BaSO4沉淀,最后用NaOH得到氢氧化镁沉淀,满足条件,故C正确;
D.由于Na2SO4能够与Ag+、Ba2+反应,无法逐一形成沉淀,故D错误;
故选C.
点评 本题考查物质的分离提纯实验方案的设计,题目难度不大,解题时要注意题目逐一沉淀的要求,熟练掌握复分解反应的实质是正确解答本题的前提.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷(P)基态原子最外层轨道表示式: | |
| B. | 钢铁发生吸氧腐蚀的正极反应式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的实验式:C6H12O6 | |
| D. | 氰基的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:S>O>N | B. | 沸点:H2O>HF>H2S | ||
| C. | 离子半径:Cl->Al3+>Mg2+ | D. | 还原性:I->S2->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用作食品添加剂 | B. | 过氧化钠可用作潜水艇供氧剂 | ||
| C. | 铝制容器可以贮运稀硝酸 | D. | 氧化铁可用作外墙涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
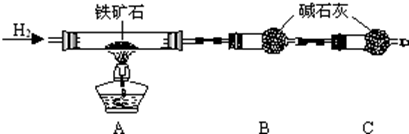
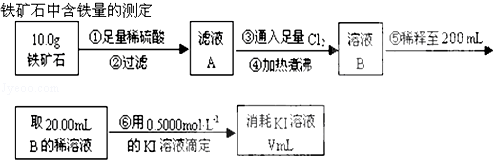
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com