
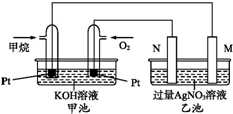
 如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.
如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.分析 碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,M为电解池的阴极,为铁电极,电解硝酸银溶液时,阴极反应式为Ag++e-=Ag;一段时间后M与N两电极的总质量增加4g,Fe为阳极,Ag为阴极,结合电子的转移的物质的量的进行计算.
解答 解:碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,负极上甲烷失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,N为阳极,电极反应式是Ag-e-=Ag+,M为阴极,电极材料是Fe,电极反应式为Ag++e-=Ag,则乙池的总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4HNO3,
(1)通入甲烷的铂电极上的电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)一段时间后M与N两电极的总质量不变,Ag为阳极,Fe为阴极,此时两电极质量差为5.4g,n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,阳极Ag溶解,阴极Ag析出,根据Ag++e-=Ag可知转移电子为0.025mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=$\frac{1}{4}$×0.025mol=0.00625mol,
V(O2)=0.00625mol×22.4L/mol=0.14L=140mL,
故答案为:Ag;140;
(3)一段时间后M与N两电极的总质量增加4g,Fe为阳极,Ag为阴极,由Fe+2Ag+=Fe2++2Ag可知,
Fe+2Ag+=Fe2++2Ag△m
56 216 160
x 4g
x=$\frac{56×4g}{160}$=1.4g,
故答案为:1.4.
点评 本题考查了原电池原理和电解池原理,为高频考点,把握原电池和电解池电极上发生反应的类型为解答的关键,题目难度不大,注意电极判断及电极反应式的.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| B. | 在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 聚合物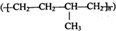 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、Fe2+、H+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com