
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
分析 A、高分子化合物的相对分子质量在10000以上;
B、油脂在碱性条件下的水解反应称为皂化反应;
C、乙醇具有还原性;
D、苯能发生加成反应.
解答 解:A、高分子化合物的相对分子质量在10000以上,而油脂的相对分子质量较小,不是高分子化合物,故A错误;
B、油脂(高级脂肪酸甘油酯)在碱性条件下的水解反应称为皂化反应,工业生产中常用此反应来制取肥皂,故B错误;
C、乙醇具有还原性,高锰酸钾溶液具有强氧化性,两者反应能使高锰酸钾溶液褪色,此反应类型为氧化反应,故C正确;
D、苯能与氢气在催化剂作用下发生加成反应生成环己烷,故D错误,
故选C.
点评 本题考查较为综合,涉及高分子化合物的概念、苯的结构和性质的考查,为高频考点,注意把握相关基础知识,学习中注意积累,难度不大.


科目:高中化学 来源: 题型:解答题
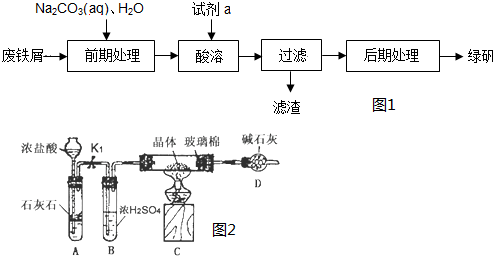
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 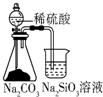 用如图可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 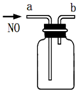 用如图装置收集一瓶纯净的NO | |
| C. |  用如图装置中U型管两端有液面差且保持不变时证明装置不漏气 | |
| D. | 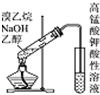 用如图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
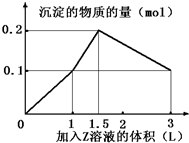 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 氯化铝、氯化铁、氢氧化钠 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 偏铝酸钠、氯化钡、硫酸 | D. | 偏铝酸钠、氢氧化钡、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com