
| A. | Na+、Ca2+、Cl-、SO${\;}_{4}^{2-}$ | B. | Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | ||
| C. | K+、Fe3+、NO${\;}_{3}^{-}$、SCN- | D. | Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{4}^{2-}$ |
分析 A.钙离子与硫酸根离子反应生成微溶物硫酸钙;
B.亚铁离子、氢离子都与亚硫酸根离子、次氯酸根离子反应;
C.铁离子与SCN-反应生成硫氰化铁;
D.四种离子之间不反应,能够共存.
解答 解:A.Ca2+、SO42-之间反应生成微溶物硫酸钙,在溶液中不能大量共存,故A错误;
B.Fe2+、H+都与SO32-、ClO-反应,SO32-、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Fe3+、SCN-之间反应生成络合物硫氰化铁,在溶液中不能大量共存,故C错误;
D.Mg2+、NH4+、Cl-、SO42-之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查了离子共存的判断,为高考的高频题,题目难度中等,明确离子反应发生条件为解答关键,注意掌握常见离子不能共存的情况,如发生复分解反应、发生氧化还原反应、生成络合物等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 试剂 |
| A | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| B | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| C | 检验Fe3O4溶于盐酸后的金属阳离子 | NaOH溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
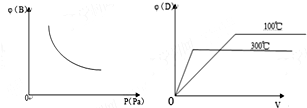
| A. | 物质C不可能为气态 | |
| B. | 正反应为吸热反应 | |
| C. | 该反应,升高温度平衡正向移动 | |
| D. | 300℃下该反应到达平衡状态后,迅速充入He,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷、辛醛 | B. | 乙炔、乙烯 | C. | 乙烯、庚烯 | D. | 苯、甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com