
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
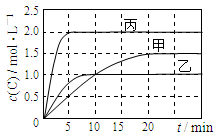
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1 ·min-1
B.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
C.由图可知:T1<T2,且该反应为放热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
BC
解析试题分析:A、由图可知,10min内甲容器中C的浓度变化量为1mol/L,v(C)=1mol/L÷10min=0.1mol/(L?min)。由于速率之比等于化学计量数之比,所以v(A)=0.1mol/(L?min)÷2=0.05mol/(L?min),故A错误;B、若x=1,反应前后气体的物质的量不变,改变体积压强不变,不影响平衡移动,故B正确;C、比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,故正反应为放热反应,故C正确;D、乙中平衡时C的浓度是1.0mol/L,则根据方程式可知,消耗A的浓度是0.5mol/L,物质的量是0.5mol/L×0.5L=0.25mol,所以A的转化率为 =
=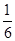 ;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为
;丙中平衡时C的浓度是2.0mol/L,则根据方程式可知,消耗A的浓度是1.0mol/L,物质的量是1.0mol/L×1L=1.0mol,所以A的转化率为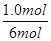 =
=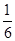 A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,则
A。丙中压强为乙中2倍,压强增大平衡不移动,故x=1,则
A(g)+B(g) 2C(g)
2C(g)
起始浓度(mol/L) 3 1 0
转化浓度(mol/L) 0.75 0.75 1.5
平衡浓度(mol/L) 2.25 0.25 1.5
故T1℃,该反应的平衡常数为K=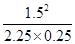 =4
=4
令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,则
A(g)+B(g) 2C(g)
2C(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) x x 2x
平衡浓度(mol/L) 1-x 3-x 2x
所以 =4
=4
解得x=0.75
所以故A的转化率=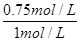 ×100%=75%,D不正确,答案选BC。
×100%=75%,D不正确,答案选BC。
考点:考查考查化学反应速率计算、影响化学平衡移动的因素、化学平衡图象与有关计算


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:单选题
可逆反应2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学习小组为了探究 BrO3-+5Br-+6H+=3Br2 +3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:zxxk
 实验编号 实验编号相关数据 | ① | ② | ③ | ④ | ⑤ |
| c(H+)/ mol · L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
| c(BrO3-)/ mol· L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
| c(Br-)/ mol· L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
| v / mol· L-1· s-1 | 2.4×10-8 | 4.8×10-8 | 1.2×10-8 | 4.8×10-8 | v1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应X (g)+Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是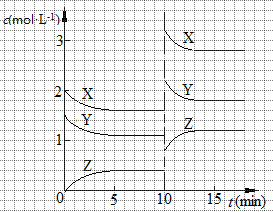
| A.反应方程式中n=1 |
| B.10 min时,曲线发生变化的原因是升高温度 |
| C.10 min时,曲线发生变化的原因是增大压强 |
| D.0~5 min内,用X表示的反应速率为v(X)="0.08" mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用铁片与0.1mol/L硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
| A.改用98%浓硫酸 | B.加热 |
| C.改用2mol/L硫酸 | D.把铁片换成铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积恒定的密闭容器中,一定量的SO2与1.1molO2发生反应: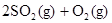
 。当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
。当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
| A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大 |
| B.反应开始时,向容器中通入的SO2的物质的量是0.7mol |
| C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2SO2(g)+O2(g) 2SO3(g) △H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是
2SO3(g) △H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是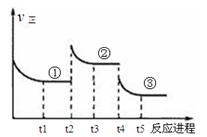
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③。
| A.t2~t3时间段,平衡向逆反应方向移动 |
| B.平衡状态①和②,平衡常数K值相同 |
| C.平衡状态①和②,SO2转化率相同 |
| D.t4时刻改变的条件是减小压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com