
向NaHSO4中逐滴滴入Ba(OH)2溶液,写出满足下列条件的离子方程式:
(1)滴到恰好使溶液呈中性:
________________________________________________________________________
______________。
(2)滴到恰好使溶液中的SO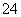 沉淀完全:
沉淀完全:
________________________________________________________________________
______________。
(1)2H++SO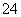 +2OH-+Ba2+===2H2O+BaSO4↓
+2OH-+Ba2+===2H2O+BaSO4↓
(2)H++SO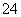 +OH-+Ba2+===H2O+BaSO4↓
+OH-+Ba2+===H2O+BaSO4↓
解析 本题是向NaHSO4中逐滴滴入Ba(OH)2溶液,NaHSO4是基准物质,H+与SO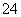 物质的量之比为1∶1。
物质的量之比为1∶1。
(1)假设溶液中存在1个H+和1个SO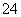 ,要使溶液呈中性,需要加入1个OH-和H+中和,而要加入1个OH-的同时必定会引入
,要使溶液呈中性,需要加入1个OH-和H+中和,而要加入1个OH-的同时必定会引入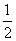 个Ba2+,只能沉淀掉
个Ba2+,只能沉淀掉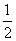 个SO
个SO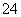 ,原溶液中还剩余
,原溶液中还剩余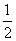 个SO
个SO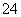 ,写出离子方程式:H++
,写出离子方程式:H++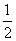 SO
SO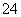 +OH-+
+OH-+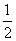 Ba2+===H2O+
Ba2+===H2O+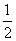 BaSO4↓,然后将方程式两侧系数同乘以2调整为2H++SO
BaSO4↓,然后将方程式两侧系数同乘以2调整为2H++SO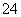 +2OH-+Ba2+===2H2O+BaSO4↓。
+2OH-+Ba2+===2H2O+BaSO4↓。
(2)类似地,要使溶液中的SO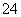 恰好沉淀完全,需要加入1个Ba2+和SO
恰好沉淀完全,需要加入1个Ba2+和SO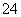 反应,而加入1个Ba2+的同时必定会引入2个OH-,原溶液中只有1个H+,所以只有1个OH-与之反应,另一个剩余在溶液中使溶液呈碱性,写出离子方程式:H++SO
反应,而加入1个Ba2+的同时必定会引入2个OH-,原溶液中只有1个H+,所以只有1个OH-与之反应,另一个剩余在溶液中使溶液呈碱性,写出离子方程式:H++SO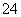 +OH-+Ba2+===H2O+BaSO4↓。
+OH-+Ba2+===H2O+BaSO4↓。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
下列反应属于离子反应的是( )
A.H2和O2反应生成水
B.锌片投入稀硫酸中
C.KMnO4加热分解制取O2
D.NH3遇氯化氢气体生成白烟(NH4Cl小颗粒)
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.醋酸钠的水解反应CH3COO-+H3O+===CH3COOH+H2O
B.碳酸氢钙与少量的NaOH溶液反应Ca2++2HCO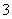 +2OH-===CaCO3↓+2H2O+CO
+2OH-===CaCO3↓+2H2O+CO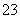
C.向AgCl悬浊液中滴加NaI溶液AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)
D.稀硝酸与过量的铁屑反应Fe+4H++NO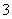 ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
| A | B | C | D | |
| 正极 | Cu | Al | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)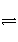
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.元素性质随原子序数的递增呈周期性变化的根本原因是元素化合价呈周期性变化
B.核外电子根据其能量的差别处于不同的电子层,电子能量越高离核越近
C.所有原子的原子核都是由质子和中子构成的
D.在元素周期表中,具有相同电子层数的元素原子所处的周期序数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com