
【题目】(题文)I. 我们已经学习了同位素、同系物、同素异形体、同分异构体,下面列出了几组物质,请用物质的组号填写下表:
有下列各组物质:
A.O2和O3(臭氧) B.12C和13C C.CH3CH2CH2CH3和CH3CH(CH3)2
D. CH4和C6H14 E.  和
和  F. H+和D+
F. H+和D+
类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
组号 | _______ | _______ | _______ | _______ |
Ⅱ.下图为四种烃的球棍模型,按要求填空

(1)等质量的以上四种烃完全燃烧,消耗O2最多的是_______(填字母序号)
(2)能说明D分子中的碳碳键不是单双键交替的事实是_________(填序号)
①D不能使酸性KMmO4溶液褪色 ②D中碳碳键的键长键能都相等
③邻二元取代产物只有一种 ④间二元取代只有一种
⑤在一定条件下D与H2发生加成反应生成环已烷
Ⅲ.按要求完成下列问题:
(1)丙烯通入到溴的四氯化碳溶液中的化学方程式:_________。
(2)戊烷的某种同分异构体的一氯代物只有一种,其结构简式为_____________。
(3)用系统命名法给下列有机物命名:
① ____________。
____________。
② ________。
________。
【答案】BDACA①②③H3C-CH=CH2 + Br2![]() CH3CHBrCH2Br;C(CH3)42-甲基戊烷4-甲基-2-己烯
CH3CHBrCH2Br;C(CH3)42-甲基戊烷4-甲基-2-己烯
【解析】
I.由“四同”的概念和区别可知12C和13C是碳元素的两种同位素;CH4和C6H14都属于烷烃同系物;O2和O3(臭氧)互为同素异形体;CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体;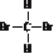 和
和  为同一种物质;H+和D+是由两种不同的氢原子形成的氢离子;故答案依次为:B、D、A、C。Ⅱ.(1)等质量的烃完全燃烧的耗氧量与烃分子中氢元素的质量分数成正比,由此分析可知CH4中氢元素的质量分数最大,故答案为A;(2)若D分子中的碳碳键是单双键交替的,其间位的二元取代物也只有一种、与氢气加后生成物也是环己烷,则④⑤两种说法不能证明D分子中的碳碳键是单双键交替出现的,故答案为①②③;Ⅲ.(1)丙烯通入到溴的四氯化碳溶液中与溴单质发生加成反应,方程式为H3C-CH=CH2 + Br2
为同一种物质;H+和D+是由两种不同的氢原子形成的氢离子;故答案依次为:B、D、A、C。Ⅱ.(1)等质量的烃完全燃烧的耗氧量与烃分子中氢元素的质量分数成正比,由此分析可知CH4中氢元素的质量分数最大,故答案为A;(2)若D分子中的碳碳键是单双键交替的,其间位的二元取代物也只有一种、与氢气加后生成物也是环己烷,则④⑤两种说法不能证明D分子中的碳碳键是单双键交替出现的,故答案为①②③;Ⅲ.(1)丙烯通入到溴的四氯化碳溶液中与溴单质发生加成反应,方程式为H3C-CH=CH2 + Br2![]() CH3CHBrCH2Br;(2)一氯代物只有一种的戊烷的同分异构体为新戊烷,结构简式为C(CH3)4或
CH3CHBrCH2Br;(2)一氯代物只有一种的戊烷的同分异构体为新戊烷,结构简式为C(CH3)4或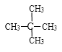 ;(3)①该烷烃的系统名称为2-甲基戊烷;②该烯烃的系统名称为4-甲基-2-己烯。
;(3)①该烷烃的系统名称为2-甲基戊烷;②该烯烃的系统名称为4-甲基-2-己烯。


科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是( )。

A. 阳极室溶液由无色变成棕黄色
B. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
C. 电解一段时间后,阴极室溶液中的pH升高
D. 当电路中通过1mol电子的电量时,阴极有0.25mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
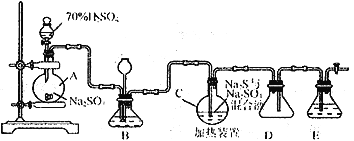
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是
2Z(g)+W(s) ΔH<0,下列叙述正确的是
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
B. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
C. 达到平衡时,反应速率v正(X)=2v逆(Z)
D. 平衡常数K值越大,X的转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期主族元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式____(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T的一种氧化物能使Z单质的水溶液褪色反应的离子方程式为______。
(5)T在周期表中的位置是第________周期,第_________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于弱电解质的说法中正确的是( )
A. 弱电解质需要通电才能发生电离
B. 醋酸溶液达到电离平衡时,不存在CH3COO-+H+![]() CH3COOH
CH3COOH
C. H2SO4是共价化合物,所以它是弱电解质;NaOH是离子化合物,所以它是强电解质
D. 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A. 原混合溶液中K+的物质的量浓度为1mol/L
B. 上述电解过程中共转移4mol电子
C. 加入CuO可使溶液恢复到原来的成分和浓度
D. 电解后溶液中H+的物质的量浓度为2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com