
| A、溶液的pH增大 |
| B、溶液中的c(H+)增大 |
| C、溶液的导电能力减弱 |
| D、溶液中的c(OH-)减小 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、在蒸馏烧瓶中盛约
| ||
| B、将温度计水银球与支管口保持水平 | ||
| C、冷水从冷凝管上口入,下口出 | ||
| D、收集蒸馏水时,应弃去开始馏出的部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
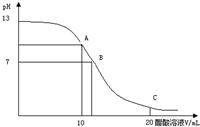 25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )
25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )| A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在A点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| D、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题:
A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银氨溶液中加入足量盐酸产生沉淀:[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O |
| C、碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- |
| D、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com