
����Ŀ��ʵ����������ͼ��ʾװ�����Ʊ���Ȳ������֤��Ȳ��ijЩ��ѧ���ʣ��Ʊ��� ��Ȳ�������������������� H2S ��PH3���壬�밴����Ҫ����գ�

(1)ʵ��������Ȳ�Ļ�ѧ����ʽ�ǣ�_________________��Ϊ�˵õ���Ϊƽ�ȵ���Ȳ������ װ�� A �ķ�Һ©���г���______________������ˮ��
(2) װ�� D �й۲쵽�������� ___________________________________________
(3) װ�� B ��CuSO4��Һ��������_______________________________��
(4)д������Ȳ��HClΪԭ�ϣ��ϳɾ�����ϩ�ķ���ʽ��________________��___________________ ��
(5)����ȡm g ��ʯ����Ӧ��ȫ�����ɵ���Ȳn g����CaC2�Ĵ���Ϊ_____(��m��n��ʾ)��
���𰸡�CaC2+2H2O��CH��CH��+Ca(OH)2 ����ʳ��ˮ ��ɫ���Ϻ�ɫ��ȥ ��ȥ H2S��PH3 ���ʣ��Է����ź���ʵ�� CH��CH+HCl��CH2=CHCl ![]()
![]()
��������
ʵ�����õ�ʯ��ˮ��Ӧ�Ʊ���Ȳ�����к������ʣ�Ϊ�˾����ͼ�����Ȳ���壬�ⶨ�������������Ҫ��װ������Ϊ�������Ʊ�װ�á�����װ�ã������⣩������װ�á�����ʵ��װ�á���ˮ�������װ�ã�
��1��ʵ�����Ʊ���Ȳ�����õ�ʯ��ˮ��Ӧ������Ȳ���������ƣ�̼������ˮ��Ӧ�ܾ��ң��ñ���ʳ��ˮ���Լ�����Ӧ��
��2����Ȳͨ�����������Һ�ᱻ�������ɶ�����̼����Һ��ɫ��
��3���Ʊ�����Ȳ��������������������H2S���壬ͨ������ͭ��Һ��ȥ���⣬��ֹӰ����Ȳ�ļ��飻
��4����Ȳ���Ȼ��ⷢ���ӳɷ�Ӧ��Ȼ�����Ӿ۷�Ӧ��
��5�����ݷ���ʽ����Ȳ���������̼���Ƶ������������CaC2�Ĵ��ȡ�
��1��ʵ�����Ʊ���Ȳ�����õ�ʯ��ˮ��Ӧ������Ȳ���������ƣ���Ӧ�Ļ�ѧ����ʽΪ��CaC2+2H2O��CH��CH��+Ca(OH)2��̼������ˮ��Ӧ�ܾ��ң��ñ���ʳ��ˮ���Լ�����Ӧ������Ϊ�˵õ�ƽ�ȵ��������ñ���ʳ��ˮ����ˮ���ʴ�Ϊ��CaC2+2H2O��CH��CH��+Ca(OH)2������ʳ��ˮ��
��2����Ȳͨ�����������Һ����Ȳ���в����ͼ��������������Һ�������ɶ�����̼��װ��D�й۲쵽����������ɫ���Ϻ�ɫ��ȥ���ʴ�Ϊ����ɫ���Ϻ�ɫ��ȥ��
��3������������л�ԭ�ԣ�Ҳ�ᵼ����ˮ�����������Һ��ɫ��װ��B��CuSO4��Һ�������dz�ȥ��Ȳ�е�H2S ��PH3���壬��ֹ���ź�������ʵ�飻�ʴ�Ϊ����ȥ H2S��PH3 ���ʣ��Է����ź���ʵ�飻
��4����Ȳ���Ȼ��ⷢ���ӳɷ�Ӧ��Ȼ�����Ӿ۷�Ӧ������ʽΪ��CH��CH+HCl��CH2=CHCl��![]() ���ʴ�Ϊ��CH��CH+HCl��CH2=CHCl��
���ʴ�Ϊ��CH��CH+HCl��CH2=CHCl��![]() ��
��
��5������ȡmg��ʯ����Ӧ��ȫ�����ɵ���Ȳng����μӷ�Ӧ��̼����Ϊxg��
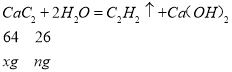
![]() ��n=
��n=![]() ����CaC2�Ĵ���Ϊ��
����CaC2�Ĵ���Ϊ��![]() =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I����ͼ�����ڼ��л���������Ʊ������롢���ʱȽϵȵij�������װ�á�����ݸ�װ�ûش��������⣺
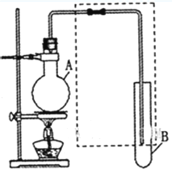
��1�������Ҵ������ᷴӦ��ȡ��������������ƿA�м�����Լ��ڻ��ʱ�IJ���������___________����Ӧ�Ļ�ѧ����ʽΪ___________���Թ�B��Ӧ����___________�����߿��еĵ��ܳ����ڵ����⣬������___________���á�
��2�����ø�װ�÷��������1-������������ƿA�г�����1�������������⣬��Ӧ�ȼ����������Լ�___________�����ȵ�һ���¶ȣ��Թ�B���ռ������ǣ���д��ѧʽ��___________����ȴ��������ƿ�м����Լ�___________�ټ��ȵ�һ���¶ȣ��Թ�B���ռ�������___________����д��ѧʽ����
��3�����ø�װ�ã����ü��ȣ�֤�����ԣ�����>̼��>���ӣ�������ƿA�м���___________���Թ�B��Ӧ����___________��
��II������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С����������װ�úϳ�����ȩ,����:CH3CH2CH2CH2OH��![]() CH3CH2CH2CHO��
CH3CH2CH2CHO��
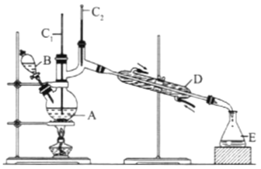
��Ӧ��Ͳ������������б�:
�е�/�� | �ܶ�/(g��cm-3) | ˮ���ܽ��� | |
������ | 11.72 | 0.8109 | �� |
����ȩ | 75.7 | 0.8017 | �� |
ʵ�鲽������:
��6.0gNa2Cr2O7����100mL�ձ���,��30mLˮ�ܽ�,�ٻ�������5mLŨ����,��������ҺС��ת����B�С���A�м���4.0g�������ͼ�����ʯ,����.������������ʱ,��ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90-95��,��E���ռ�90�����µ���֡�������ﵹ���Һ©����,��ȥˮ��,�л�����������,�ռ�75-77�����,����2.0g��
�ش���������:
��1��ʵ����,�ܷ�Na2Cr2O7��Һ�ӵ�Ũ������,˵������:__________��
��2�������ʯ��������__________�������Ⱥ���δ�ӷ�ʯ,Ӧ��ȡ����ȷ������__________��
��3������װ��ͼ��,B������������__________,D������������__________��
��4����Һ©��ʹ��ǰ������еIJ�����(����ĸ)__________��
A.��ʪ B.���� C.��© D.�궨
��5��������ȩ�ֲ�Ʒ���ڷ�Һ©���з�Һʱ,ˮ��__________��(��������,��������)��
��6����Ӧ�¶�Ӧ������90~95��,��ԭ����__________��
��7����ʵ����,����ȩ�IJ���Ϊ__________%��.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹���������ȷ����
A. ![]() �����ϵ�һ��ȡ������5��
�����ϵ�һ��ȡ������5��
B. ���飨C4H10���Ķ���ȡ���������4��
C. �ƵĽṹ��ʽΪ ����һ����ȡ������10��
����һ����ȡ������10��
D.  ��
�� ��Ϊͬ���칹��
��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ռ�ʵ�������칬һ�����Ĺ���ϵͳ������������ȼ�ϵ�أ�RFC����RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ���ء���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ���ǣ� ��

A. ����0.8mol����ת��ʱ��b������4.48LO2
B. Ϊ�����ӵ����Կ��Խ���������е�ˮ��ΪNaOH��Һ
C. d���Ϸ����ĵ缫��Ӧ�ǣ�2H+ +2e��=H2
D. c���Ͻ���������Ӧ��A���е�H+����ͨ����Ĥ����B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.005molL��1Ba(
OH)
2��Һ��pHֵΪ��������
A.10B.11C.12D.13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¿���M���Ʊ���Ч��������ճ�ϼ��ȶ��־�ϸ��ѧƷ����Ҫԭ�ϣ��ɾ����з�Ӧ·�ߵõ�(���ַ�Ӧ��������)��

��֪����R-CH2-Cl + NaCN �� R-CH2-CN + NaCl
��R-CH2-CN + NaOH + H2O �� R-CH2-COONa + NH3
���������գ�
(1)A�Ľṹ��ʽ��_____________��M�й����ŵ�������________________��
(2)д��B�� C�Ļ�ѧ��Ӧ����ʽ________________________________________��д��G�Ľṹ��ʽ______________________________________
(3)��Ӧa�뷴Ӧb���Ⱥ�˳���ܵߵ�������ԭ��_________________________________________________________________________��
(4)д����A��1,3������ϩ1:1�������ø߾���Ľṹ��ʽ____________________________
(5)�������CH2=CHCH2OH �Ʊ�CH2=CHCOOH�ĺϳ�·��(���Լ���ѡ)________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ����![]()
A.ʹPH��ֽ��ɺ�ɫ����Һ�����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
B.![]() ��Һ�У����ܴ��ڴ����ģ�
��Һ�У����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
C.�����ữ�ĵ���KI��Һ�ڿ����б����ɫ��![]()
D.![]() ��Һ�еμ���������ʯ��ˮ��
��Һ�еμ���������ʯ��ˮ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ĸ������ʾһ�ַ�Ӧ���������(ijЩ�����Ѿ���ȥ)�����г�����A��C��DΪ��ɫ���壬C��ʹʪ��ĺ�ɫʯ����ֽ������
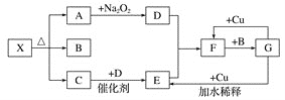
��1��д������X�Ļ�ѧʽ��__��
��2��д�����б仯�Ļ�ѧ����ʽ��
��A��D��___��
��G��E��___��
��F��G��___��
��3��ʵ��������ü��ȹ�������ķ�����ȡ����C����д����ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����״���£���500L��������ˮ�γ�1L��ˮ����˰�ˮ�����ʵ���Ũ��Ϊ____mol��L-1��������λ��Ч���֣�����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ____��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ____��
���з�Ӧ�еİ��백�������еİ�������ͬ����____��
A.2Na+2NH3=2NaNH2+H2�� B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH-=NO2-+NO3-+H2O��NO+NO2+2OH-=____+H2O����ƽ�÷���ʽ����
��3����27.2gCu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1L1mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ____��
��Cu��Cu2O�����ʵ���֮��Ϊ____��
��HNO3�����ʵ���Ũ��Ϊ____mol��L-1��
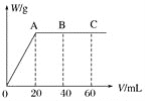
��4����H2SO4��HNO3�Ļ����Һ20mL������0.25molL-1Ba��OH��2��Һʱ�����ɳ���������w��g����Ba��OH��2��Һ�����V��mL���Ĺ�ϵ��ͼ��ʾ��C����Һ�����ԣ�����ԭ���Һ��H2SO4�����ʵ���Ũ��Ϊ____mol��L-1��HNO3�����ʵ���Ũ��Ϊ____mol��L-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com