
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
组别 C(HCL)(mol/L) 温度(℃) 状态
1 2.0 25 块状
2 2.5 30 块状
3 2.5 50 块状
4 2.5 30 粉末状
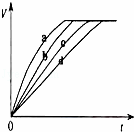
A. 3﹣4﹣1﹣2 B. 1﹣2﹣4﹣3 C. 4﹣2﹣3﹣1 D. 4﹣3﹣2﹣1
考点: 化学反应速率的影响因素.
分析: 盐酸浓度、温度、反应物接触面积都影响反应速率,盐酸浓度越大、温度越高、反应物接触面积一定,反应速率越大,反应完全需要的时间越短.
解答: 解:盐酸浓度、温度、反应物接触面积都影响反应速率,盐酸浓度越大、温度越高、反应物接触面积一定,反应速率越大,反应完全需要的时间越短,根据表中数据知,反应速率大小顺序是4﹣3﹣2﹣1,则反应完全需要时间长短顺序是1﹣2﹣3﹣4,根据图象知,反应速率大小顺序是a、b、c、d,
故选D.
点评: 本题考查化学反应速率影响因素,侧重考查学生分析判断能力,利用温度、浓度、反应物接触面积分析解答即可,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
据报道,某些建筑材料会产生放射性同位素氡 ,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
,从而对人体产生伤害,该同位素原子的中子数和质子数之差是( )
|
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下实验能获得成功的是( )
|
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
|
| B. | 用氨水清洗试管壁附着的银镜 |
|
| C. | 对苯和硝基苯采用分液的方法分离 |
|
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率和限度的说法中,不正确的是( )
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用粉末状碳酸钙比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
人造地球卫星用到的一种高能电池﹣﹣银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液.放电时,该电池的电极反应式为:Zn+2OH﹣﹣2e﹣═Zn(OH)2,Ag2O+H2O+2e﹣═2Ag+2OH﹣.下列说法中正确的是( )
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH﹣浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
A. ① B. ①②④ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G
3 B C J F H I
(1)表中元素,化学性质最不活泼的是 ,只有负化合价而无正价的元素是 ,可用于制半导体材料的元素是 .
(2)最高价氧化物的水化物中碱性最强的是 ,酸性最强的是 .
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是 ;
(5)写出D的氢化物的电子式 ;
(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有 .
(7)用电子式表化合物BH的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. pH=1的稀硫酸中含有的H+数为0.1NA
B. 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
C. 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D. 80g NH4NO3晶体中含有NH4+小于个NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com