
| A. | 用硝酸银溶液区分碳酸钠和氯化钠 | |
| B. | 用硝酸钡溶液区分碳酸钠和硫酸钠 | |
| C. | 用氯化钙溶液区分碳酸钠和碳酸氢钠 | |
| D. | 用盐酸区分氢氧化钠和氯化钠 |
分析 A.二者均与硝酸银反应生成白色沉淀;
B.二者均与硝酸钡反应生成白色沉淀;
C.碳酸钠与氯化钙反应生成白色沉淀,而碳酸氢钠不反应;
D.NaOH与HCl反应生成氯化钠和水,现象不明显,而盐酸与NaCl不反应.
解答 解:A.二者均与硝酸银反应生成白色沉淀,现象相同,不能鉴别,应选盐酸鉴别,故A错误;
B.二者均与硝酸钡反应生成白色沉淀,现象相同,不能鉴别,应选盐酸鉴别,故B错误;
C.碳酸钠与氯化钙反应生成白色沉淀,而碳酸氢钠不反应,现象不同,可鉴别,故C正确;
D.NaOH与HCl反应生成氯化钠和水,现象不明显,而盐酸与NaCl不反应,现象不能鉴别,故D错误;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与鉴别实验能力的考查,注意现象相同不能鉴别物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和水的反应:C12+H2O═2H++Clˉ+ClOˉ | |
| B. | 向Al2(SO4)2溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 硫酸氢铵溶液中加入过量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 铜片加入稀硝酸中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3→Fe(OH)3 | B. | Al(OH)3→Al2O3 | C. | SO3→H2SO4 | D. | Fe3+→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
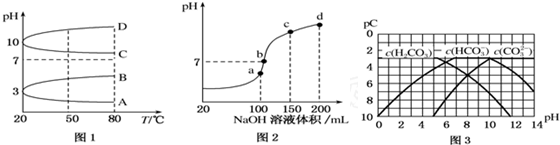
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na着火,可立即用水扑灭 | |
| B. | 炒菜时油锅里着火了,可关掉火源并用锅盖盖灭 | |
| C. | 贮氯罐意外泄漏,应向贮氯罐周围空中喷洒稀NaOH溶液 | |
| D. | 闻氯气的气味时,应用手在瓶口轻轻煽动,使少量氯气进入鼻孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
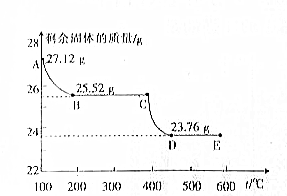
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com