
| A. | 浓硝酸 | B. | 氢氟酸 | C. | 氢氧化钠溶液 | D. | 硝酸银固体 |
分析 见光易分解的物质用棕色瓶盛放,液体用细口瓶,固体用广口瓶盛放,玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,能和氢氟酸反应,带玻璃塞的试剂瓶不能存放呈强碱性的物质,据此完成本题.
解答 解:A.浓硝酸见光易分解,宜用棕色、细口、配有磨口塞玻璃瓶,故A正确;
B.氢氟酸和二氧化硅反应生成四氟化硅,所以不能用玻璃瓶盛放氢氟酸,要用塑料瓶盛放,故B错误;
C.NaOH呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不能盛放在带有玻璃塞的试剂瓶中,故C错误;
D.硝酸银固体应用广口瓶盛放,故D错误.
故选A.
点评 本题以试剂的存放为载体考查了硅酸钠的性质、玻璃的成分等知识点,难度不大,试剂的存放遵循安全性、保纯性、方便性原则,本题有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都等于零 | B. | CO、H2S、COS、H2的浓度相等 | ||
| C. | CO、H2S、COS、H2在容器中共存 | D. | CO、H2S、COS、H2的浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
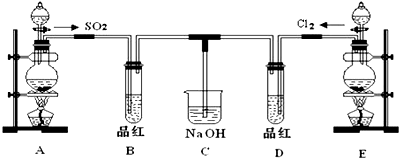
 ;请指出该反应中的液体反应物在反应中所表现出的化学性质:还原性和酸性;若液体中的溶质反应了6mol,则转移的电子的物质的量3mol;
;请指出该反应中的液体反应物在反应中所表现出的化学性质:还原性和酸性;若液体中的溶质反应了6mol,则转移的电子的物质的量3mol;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
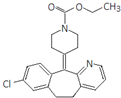
| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com