
【题目】4-羟基香豆素是医药中间体,用于生产抗凝血药物,其结构简式如图所示。下列说法正确

A. 分子式为![]()
B. 所有原子一定处于同一平面
C. 苯环上的一氯代物有2种
D. 与HCl加成能生成2种同分异构体(不考虑立体异构)
【答案】D
【解析】
从有机物的结构可看出该有机物含有酯基、羟基、碳碳双键。该物质的空间结构中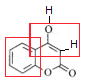 构成苯环的12个原子共平面,由碳碳双键所连接的6个原子共平面。
构成苯环的12个原子共平面,由碳碳双键所连接的6个原子共平面。
A.该有机物共有9个碳原子,3个氧原子,6个氢原子,所以其分子式应为![]() ,A项错误;
,A项错误;
B.该有机物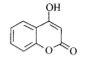 中,构成苯环的12个原子肯定共平面,由碳碳双键所连接的6个原子肯定共平面,即
中,构成苯环的12个原子肯定共平面,由碳碳双键所连接的6个原子肯定共平面,即 。但羟基上的氢原子可以通过单键的旋转不与其它原子共平面,所以所有原子不一定处于同一平面,B项错误;
。但羟基上的氢原子可以通过单键的旋转不与其它原子共平面,所以所有原子不一定处于同一平面,B项错误;
C.因该有机物苯环上的两个取代基不相同,所以苯环上的一氯代物有4种即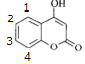 ,C项错误;
,C项错误;
D.该有机物结构中只有碳碳双键能与HCl发生加成反应,生成2种同分异构体分别是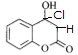 、
、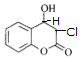 ,D项正确;
,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】四碘化锡(Snl4,M=627g/mol)是一种橙色针状晶体,遇水易发生水解,可在非水溶剂中由Sn和l2直接化合得到,实验装置如图(1)(加热装置略去)所示。

实验步骤如下:
组装仪器并加入药品后,通入冷凝水,加热圆底烧瓶,控制反应温度在80℃左右,保持回流状态,直到反应完全。取下仪器A、B,趁热将溶液倒入干燥的烧杯中,用热的CCl4洗涤圆底烧瓶内壁和锡片,并将洗涤液合并入烧杯内。再将烧杯置于冷水浴中冷却即析出Snl4晶体。
请回答下列问题:
(1)仪器B的名称为___________,冷凝水的进口为____________(填“甲”或“乙”)。为了控制反应温度,对圆底烧瓶适宜的加热方式是____________________。
(2)仪器A中盛放的试剂为无水CaCl2,其作用为____________。
(3)反应完全的现象为__________,用热的CCl4洗涤圆底烧瓶内壁和锡片的目的是_______,从烧杯中获取产品的操作名称为______________。
(4)产品的纯度可用滴定法测定:称取m g产品,加入足量的水,使产品充分水解[SnI4+(2+x)H2O=SnO2·xH2O↓+4HI]。将上层清液全部定容于250mL容量瓶中。移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用c mol/L的标准FeCl3溶液滴定至终点,平行测定三次,平均消耗标准FeCl3溶液的体积为1mL。(已知:2Fe3++2I-![]() 2Fe2++I2)
2Fe2++I2)
①下列关于滴定分析,不正确的是________。
a.图(2)中为避免滴定管漏液,应将凡士林涂在旋塞的a端和旋塞套内的c端
b.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶的内壁
c.当下层溶液变为紫红色且半分钟不褪色即为滴定终点
d.若不加CCl4,则测得样品的纯度可能偏高
②产品纯度的表达式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实验操作不能达到实验目的或得出相应结论的是
选项 | 实验操作 | 实验目的或结论 |
A | 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,完全反应后收集H2的体积 | 比较两种酸的电离程度 |
B | 将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中的Ca(OH)2杂质 |
C | 向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/L NaI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,在直流电场的作用下,两膜中间的NH4+和NO2—可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.工作一段时间后,在两极区均得到副产品NH4NO3.下列叙述正确的是

A. a极为电源负极,b极为电源正极
B. c膜是阴离子交换膜,d膜是阳离子交换膜
C. 阴极电极反应式为2NO3-+12H++10e-=N2 +6H2O
D. 当电路中通过1mol电子的电量时,会有5.6LO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com