
 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.分析 (1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$=7:11;
(3)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式;依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
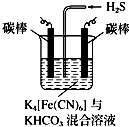
(4)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断.
解答 解:(1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高,发生的离子反应为2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O,
故答案为:2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$=7:11,则化学式为Fe7O11,故答案为:Fe7O11;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+; 3;
(4)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大.
点评 本题考查氧化还原反应计算及电解等,综合性较强,注重氧化还原反应应用能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
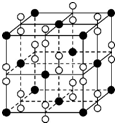 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氧 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1 681 | 1 251 | 1 140 | 1 008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
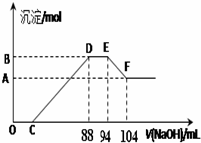
| A. | 稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 | |
| B. | 图中C点对应溶液体积为48mL | |
| C. | 原硝酸溶液中含硝酸的物质的量为0.5mol | |
| D. | 样品中铝粉和铁粉的物质的量之比5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9gH2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| D. | 标准状况下,11.2L CCl4所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  反应过程中能量关系可用图表示 | |
| B. | 该反应为自发反应 | |
| C. | 若将该反应设计成原电池则锌为负极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com