
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.Cr2O72-和CrO42-的浓度相同,不一定平衡,故错误;
b.2υ(Cr2O72-)=υ(CrO42-)不能证明正逆速率相等,所以不是平衡状态,故错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故正确;
故选c;
(3)还原1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子6mol,亚铁离子被氧化为+3价,应该得到6mol电子,所以还原1mol Cr2O72-离子,
需要6mol的FeSO4•7H2O,故答案为:6;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{{K}_{sp}}{c(C{r}^{3+})}}$=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑,氢离子浓度减少溶液的酸性减弱;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ,反应类型:加聚反应
,反应类型:加聚反应 ,反应类型:取代反应
,反应类型:取代反应 ,反应类型:取代反应
,反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
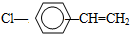 ,该有机物能发生( )
,该有机物能发生( )| A. | 只有③⑥不能发生 | B. | 只有⑥不能发生 | ||
| C. | 只有①不能发生 | D. | 以上反应均可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢管与铅连接,钢管可被保护 | |
| B. | 铁遇冷浓硫酸表面钝化,可保护内部不被腐蚀 | |
| C. | 纯铁比生铁更容易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com