
 (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量;
(2)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答;
解答 解:(1)反应热=化学键断裂吸收的总能量-化学键形成放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436 kJ-2×3×391kJ=-92kJ,所以是放出热量;
1mol H2生成NH3的反应热=$\frac{1}{3}$×946kJ+436kJ-$\frac{2}{3}$×3×391kJ=-30.7kJ,所以是放出热量;
故答案为:①放出;92 ②放出;30.7;
(2)①镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为:镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体;
故答案为:镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体;
②镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出;故答案为:镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量;
故答案为:小于.
点评 本题考查了反应热的计算以及通过镁与盐酸的反应,考查了放热反应、氢氧化钙溶解度特点,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (C)
(C) (D)
(D)
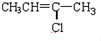 (G)
(G)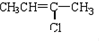 (H)
(H)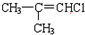
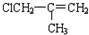 (J)
(J)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
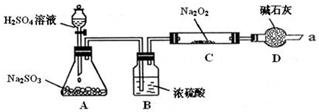

| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和蛋白质水解的最终产物都只有一种 | |
| B. | 蔗糖和淀粉都不能发生氧化反应 | |
| C. | 棉花、合成纤维、ABS树脂、蚕丝和核酸都属于高分子化合物 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com